СРЕДСТВА СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ, ТЕРАПИИ И ДИАГНОСТИКИ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 7 страница
С целью видовой идентификации исследуют ферментативные свойства. V. pseudotuberculosis образует уреазу, расщепляет рамнозу, мелибиозу, не обладает лизин-орнитиндекарбоксилазами, не гидролизует желатин, не образует индол, не утилизирует цитрат Симмонса и не дает реакцию Фогес—Проскауера при 25 º С. Для серовариантной идентификации выделенных культур возбудителя применяют серологические реакции. Y. pseudotuberculosis подразделяют на шесть серологических групп (I...VI) по термостабильным антигенам и пять вариантов — по жгутиковым антигенам. Биопроба. Тканевым гомогенатом или выделенной культурой заражают подкожно или внутрибрюшинно белых мышей, морских свинок, кроликов. Мыши погибают через 2...4 дня, морские свинки и кролики — через 2...35 дней в зависимости от вирулентности культуры. Из органов павших подопытных животных делают посевы на питательные среды для выделения культуры возбудителя, готовят и микроскопируют окрашенные мазки и отпечатки. ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ 1. Описать характер роста Y. septis и Y. pseudotuberculosis на МПА и в МПБ. 2. Промикроскопировать мазки из культур Y. pestis и Y. pseudotuberculosis. 3. Ознакомиться с биопрепаратами. Контрольные вопросы 1. Каковы основные морфологические признаки чумных бактерий? 2. Какие тесты используют для дифференциации возбудителей чумы от бактерий псевдотуберкулеза? 3. В чем заключаются особенности биопробы при чуме? 4. При какой температуре можно культивировать возбудителей чумы и псевдотуберкулеза? 5. Какие животные наиболее восприимчивы к псевдотуберкулезу?
Тема 32 ЛАБОРАТОРНАЯ ДИАГНОСТИКА БРУЦЕЛЛЕЗА, ТУЛЯРЕМИИ. БИОПРЕПАРАТЫ Цель занятий. Ознакомить студентов со свойствами возбудителей и лабораторной диагностикой бруцеллеза и туляремии, а также биопрепаратами. Оборудование и материалы. Единый бруцеллезный антиген, антиген для кольцевой реакции с молоком, роз-бенгал антиген, позитивная бруцеллезная сыворотка, негативная сыворотка, физиологический раствор, содержащий 0, 5 % фенола, серологические пробирки, штативы, мерные пипетки, красители для окраски по Граму, Козловскому (Стампу), пробы молока.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ Бруцеллез. Это хроническая инфекционная болезнь, проявляющаяся абортами, задержанием последа, эндометритами и расстройством воспроизводительной функции животных. Восприимчивы многие виды сельскохозяйственных животных и человек. Возбудитель — бактерии рода Brucella: В. melitensis (три биовара) — основной хозяин овцы и козы; В. abortus (девять биоваров) — основной хозяин крупный рогатый скот; В. suis (четыре биовара) — основной хозяин свиньи, а также северные олени и зайцы; В. ovis — основной хозяин овцы; В. neotomae — основной хозяин древесные крысы; В. canis — основной хозяин собаки. Лабораторная диагностика бруцеллеза основана на результатах бактериологических и серологических исследований. Бактериологическое исследование в основном применяют при первичной постановке диагноза на бруцеллез в ранее благополучных хозяйствах. Материал для исследования. В лабораторию направляют пробы крови (сыворотки) для серологических исследований, абортированный плод с плодными оболочками, околоплодную жидкость, истечения из родовых путей или желудок плода, кусочки печени, селезенки, пробы молока (последние порции). При убое животных берут паренхиматозные органы, лимфатические узлы, пораженные суставы, у самцов — семенники. Объектом исследования могут быть молочные продукты (брынза, сыр, масло и др.), объекты внешней среды. Микроскопия препаратов из исходного материала. Мазки из материала окрашивают по Граму и одним из специальных методов (по Козловскому, Стампу и др.). Бруцеллы — грамотрицательные короткие палочковидные или кокковидные бактерии размером 0, 5... 1, 5 мкм, без жгутиков, спор не образуют, формируют микрокапсулу. В окрашенном препарате располагаются одиночно, реже парами, короткими цепочками. Окраска по методу Козловского: препарат окрашивают 2%-м водным раствором сафранина 2 мин, промывают водой, докрашивают 1%-м водным раствором малахитовой зелени 1 мин, промывают водой. Микроскопическая картина: бруцеллы красные, остальные бактерии зеленые. Окраска по методу Стампа: фиксированный на пламени мазок окрашивают фуксином Пфейффера 10 мин, промывают водой, обрабатывают 0, 5%-м водным раствором уксусной кислоты 30 с, затем препарат промывают водой и докрашивают 1%-м водным раствором метиленового синего 20...30 с. Микроскопическая картина: бруцеллы красные, другие бактерии синие. Выделение и идентификация культуры возбудителя. Бруцеллы — аэробы, микроаэрофилы, температурный оптимум 37...38 °С, рН 6, 8...7, 2. Материал засевают на специальные питательные среды: мясо-пептонный агар и бульон, печеночно-глюкозо-глицериновый агар и бульон, картофельный агар, эритрит-агар, сывороточ-но-декстрозный агар и др. Печеночные среды включают в себя отвар печени. Картофельный агар готовят на отваре картофеля, глюкозу и глицерин добавляют в среды соответственно в количестве 1 % и 2...3 %. Эритрит-агар содержит вещество (эритрит), стимулирующее рост бруцелл. В состав сывороточно-декстрозно-го агара помимо обычной питательной основы входит 10 % сыворотки крови и 1 % декстрозы. Некоторые виды бруцелл растут при повышенном содержании в атмосфере оксида углерода (IV) (В. abortus, В. ovis). Так как неизвестно, каким видом бруцелл заражен исследуемый материал, половину посевов инкубируют в обычной атмосфере, другую — в атмосфере, содержащей 10...15% оксида углерода (IV). Посевы культивируют в течение ЗО сут, периодически просматривая. Рост бруцелл чаще появляется на 7... 10-е сутки, иногда позже.
На плотных средах возбудитель формирует мелкие, прозрачные, круглые, с ровными краями, гладкой поверхностью, с голубоватым оттенком колонии (S-форма), возможно появление шероховатых колоний (R-форма) (рис. 99, 100). По мере старения колонии мутнеют и за счет пигментообразования могут темнеть. На жидких питательных средах рост бруцелл проявляется равномерным помутнением среды, образованием голубоватого пристеночного кольца, позднее формируется небольшой осадок. У выросших культур изучают морфологию и тинкториальные свойства клеток в мазках, окрашенных по методам Грама, Козловского. Культуру идентифицируют серологически в РА на стекле с позитивной бруцеллезной сывороткой, разведенной в соотношении 1: 50. Виды В. melitensis, В. abortus, В. suis антигенно родственны, поэтому их клетки агглютинируют в стандартной бруцеллезной сыворотке. Для идентификации В. ovis кроликов иммунизируют выделенной культурой и затем кроличью сыворотку исследуют в РДСК со стандартным овисным антигеном (В. ovis) — должна быть четкая положительная реакция, если это культура В. ovis.
Рис. 100. Бруцеллы в чистой культуре
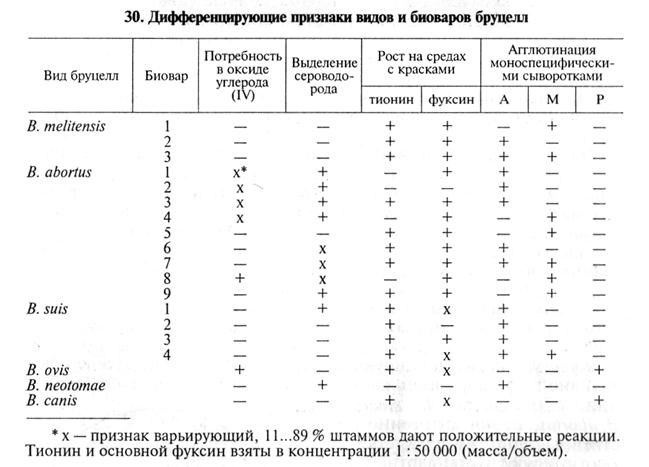
Для определения видовой принадлежности у выделенных культур бруцелл изучают потребность в оксиде углерода (IV), образование сероводорода, способность к росту на питательных средах с тионином и фуксином, чувствительность к бруцеллезным бактериофагам, ферментацию аминокислот, углеводов, а также агглютинабильность с моноспецифическими сыворотками против отдельных клеточных антигенов бруцелл (А, М, R). Некоторые из дифференцирующих характеристик приведены в таблице 30.
Биопроба. Это эффективный метод обнаружения бруцелл в исследуемом материале, особенно загрязненном. Морских свинок перед заражением исследуют в РА, в опыт берут животных, в сыворотке которых не обнаружены антитела к возбудителю. Тканевый материал в виде суспензии (1: 10) в объеме 1 мл вводят подкожно. О результате биопробы судят по данным исследования сыворотки крови на 15, 25 и 40-й день после заражения (животные не погибают). Появление антител в титре 1: 10 и более оценивают как положительный результат. Реагирующих животных убивают и подвергают бактериологическому исследованию. Серологическая диагностика: при массовых диагностических исследованиях ставят пробирочную РА, роз-бенгал пробу (РА на стекле), РСК, РДСК, кольцевую реакцию с молоком (КР). Пробирочная РА. Реакцию ставят в объеме 1 мл. Сыворотки крови крупного рогатого скота, лошадей, собак, пушных зверей, верблюдов разводят физиологическим раствором, содержащим 0, 5 % фенола; сыворотки крови овец коз, буйволов разводят 5%-м, а сыворотки оленей — 10%-м фенолизированным физиологическим раствором. Сыворотки крови крупного рогатого скота, лошадей, верблюдов исследуют в разведениях от 1: 50 до 1: 400; овец, коз, свиней, буйволов, оленей, собак — в разведениях 1: 25 и более; пушных зверей — 1: 10 и более. При массовых исследованиях сыворотки крови исследуют в двух первых разведениях. После приготовления разведений сыворотки в объеме 0, 5 мл в каждую пробу добавляют 0, 5 мл разведенного до концентрации клеток 5*108/мл единого бруцеллезного антигена (при этом разведения удваиваются), компоненты перемешивают встряхиванием, штатив с пробирками помещают в термостат при 37...38 º С на 18...20 ч, затем оставляют на несколько часов при комнатной температуре. Результат учитывают по общепринятой системе (см. тему 15). В качестве контролей параллельно исследуют заведомо положительную и отрицательную сыворотки. РА при бруцеллезе крупного рогатого скота, лошадей и верблюдов считают положительной, если титр составляет 1: 100 и более (1: 50 — сомнительный результат), у овец, коз, оленей, буйволов и собак — 1: 50 (1: 25 — сомнительный результат). При получении сомнительных реакций сыворотки крови от этих животных исследуют повторно через три-четыре неделим. В ходе массовых серологических исследований практикуют исследование сывороток в двух первых разведениях. При этом необходимо учитывать, что некоторые сыворотки, не агглютинирующие антиген в малых разведениях, в более высоких разведениях дают положительный результат — этот так называемый феномен «про-зоны», который может служить причиной ложных отрицательных результатов. В разных странах для пробирочной РА готовят антигены, различающиеся по агглютинабильности, что делает несопоставимыми титры, полученные при исследованиях. Поэтому рекомендовано выражать результат пробирочной РА в международных единицах (ME). Для этого предложена международная стандартная бруцеллезная сыворотка, по отношению к которой и определяют активность национальных антигенов. Активность этой сыворотки установлена в 1000 ME. Например, с каким-то национальным антигеном международная сыворотка в пробирочной РА показывает титр 1: 500, значит, если с этим антигеном какая-либо другая сыворотка дает титр РА 1: 500, то она содержит 1000 МЕ, если вторая исследуемая сыворотка показывает титр 1: 400, то ее активность в международных единицах составит 1000 • 400/500 = 800 ME и т.д. В каждой стране разработана национальная бруцеллезная стандартная сыворотка, соответствующая по активности международной. По указанным критериям положительные титры РА на бруцеллез для крупного рогатого скота составляют 100 ME (50 ME — сомнительный результат), для овец, коз, буйволов, оленей и собак — 50 ME (25 ME — сомнительный результат). Роз-бенгал проба (РБП). В отличие от пробирочной РА данная серологическая реакция является качественной. С ее помощью в сжатые сроки исследуют большое количество животных. Сыворотки, давшие положительную РБП, дополнительно исследуют в пробирочной РА и РСК. Техника постановки РБП изложена в теме 15. В РБП исследуют неразведенную сыворотку крови, влияние нормальных антител на специфичность реакции нивелируется использованием антигена с кислыми значениями рН, при которых нормальные антитела с низкой авидностью не реагируют с антигеном, что обеспечивает достаточно высокую специфичность РБП. РСК. Реакцию ставят в объеме 1 мл. Предварительно инакти-вированные в течение 30 мин сыворотки крови (лошадей при 56...58 °С, крупного рогатого скота при 60...62 °С, свиней при 60...62°С, овец и коз при 58...60°С) исследуют в разведении 1: 5...1: 10. Положительным результатом РСК (РДСК) считают задержку гемолиза на два креста и более в разведении сыворотки крови 1: 5. Кольцевая реакция с молоком (КР). Метод применяют для ориентировочной проверки благополучных по бруцеллезу молочных стад и для контроля молока на рынке. В бактериологическую пробирку наливают 2 мл исследуемого молока, добавляют 0, 1мл антигена — клетки бруцелл, окрашенные гематоксилином. Пробирки встряхивают и помещают в водяную баню при 37...38 º С на 45...50 мин, после чего учитывают результат. Положительный результат — верхняя часть столбика молока (сливки) синего цвета, остальное молоко белое или слегка синеватое. Отрицательный результат — слой сливок белый, молоко равномерно окрашено в синий цвет. Сомнительный результат — сливки слабо окрашены в синий цвет, молоко синего цвета. Аллергическая диагностика не принадлежит к лабораторным методам; ее применяют непосредственно в хозяйствах. При бруцеллезе развивается состояние гиперчувствительности замедленного типа (ГЗТ), которое может сопровождаться синтезом антител, улавливаемых в серологических реакциях, но иногда ГЗТ отмечают при отрицательных показаниях серологических тестов. Для обнаружения ГЗТ у животных используют диагностический аллерген — бруцеллин (см. тему 20). Биопрепараты. Вакцина из штамма В. abortus № 19. Это наиболее изученная вакцина. Вакцинный штамм выращивают на плотных питательных средах. Устанавливают концентрацию микробных клеток 8 • 1010/мл, лиофильно высушивают. Готовый препарат контролируют на чистоту роста, диссоциацию, безвредность на морских свинках и белых мышах, одновременно у морских свинок проверяют наличие серологического ответа на введение вакцины. Иммуногенность препарата контролируют на морских свинках. Живая сухая вакцина против бруцеллеза из слабоагглютино-генного штамма № 82 отличается от вакцины из штамма № 19 слабым серологическим ответом с быстрым снижением уровня гуморальных антител, что позволяет при помощи серологических реакций дифференцировать вакцинированных животных. Единый бруцеллезный антиген для РА, РСК и РДСК получают следующим образом: культуру вакцинного штамма № 19 выращивают на плотной питательной среде, бактериальную массу инактивируют, проверяют на чистоту и стерильность путем микроскопии и высевом на питательные среды. Контролируют на специфичность с физиологическим раствором и негативной сывороткой. Активность проверяют в РА и РСК с национальной стандартной бруцеллезной агглютинирующей сывороткой. Антиген для кольцевой реакции с молоком. Микробную массу культуры В. abortus (штамм № 19) готовят, как для единого бруцеллезного антигена, инактивируют, устанавливают необходимую концентрацию микробных клеток, протравливают сульфатом железа, окрашивают в синий цвет гематоксилином, контролируют на стерильность, специфичность и активность (см. тему 20). Роз-бенгал антиген представляет собой суспензию бруцелл в буферном растворе (рН 3, 6), инактивированных нагреванием и фенолом, окрашенных бенгальским розовым в малиново-розовый цвет. Антиген контролируют на стерильность, чистоту, рН. Специфичность проверяют с физиологическим раствором и негативными сыворотками, активность — методом титрования с национальной стандартной сывороткой. Флуоресцирующую бруцеллезную сыворотку готовят из позитивной бруцеллезной сыворотки, глобулины которой метят флуоресцеинизотиоцианатом. Позитивную бруцеллезную сыворотку получают гипериммунизацией животных-продуцентов. Используют для контроля при постановке серологических реакций (РА, РСК и др.), а также серологической идентификации бруцелл. Диагностический аллерген-бруцеллин представляет собой стерильную, прозрачную, желтоватого цвета жидкость, содержащую продукты жизнедеятельности бруцелл и вещества, извлеченные из них. Бактериальную массу выращивают (штамм В. abortus В-1) на агаровой среде, прогревают при 105... 110 °С 1ч, центрифугируют, надосадочную жидкость стерилизуют фильтрованием, бактериальную массу ресуспендируют в физиологическом растворе. Процедуру нагревания, центрифугирования и стерилизации повторяют, после чего оба фильтрата объединяют. Полученный препарат контролируют, как описано ранее (см. тему 20). Туляремия. Острая инфекционная болезнь. У сельскохозяйственных животных обычно протекает в септической форме. Характеризуется увеличением лимфатических узлов, симптомами поражения нервной системы, у крупного рогатого скота может проявляться маститами, у лошадей — абортами. Из сельскохозяйственных животных к возбудителю туляремии наиболее чувствительны поросята, ягнята, из диких животных — грызуны. Восприимчив человек. Возбудитель туляремии — бактерия Francisella tularensis (принадлежит к роду Francisella). Подразделяют на два биовара: F. tularensis sb. tularensis и F. tularensis sb. palaearctica. Для вида F. novicida характерна незначительная вирулентность. Лабораторная диагностика туляремии основана на результатах бактериологического исследования. Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии, выделение чистой культуры методом биопробы и посевом на питательные среды; идентификацию возбудителя по культурально-морфологическим, ферментативным, серологическим свойствам. Материал для исследования. Для прижизненной диагностики в лабораторию направляют мочу, фекалии, абортированный плод; для посмертной — печень, почки, селезенку, увеличенные лимфатические узлы; трупы мелких животных, грызунов — целиком. При необходимости материал консервируют глицерином. Микроскопия препаратов из исходного материала. Мазки-отпечатки окрашивают по Граму и Романовскому—Гимзе. F. tularensis -— мелкая [(0, 3...0, 7) х (0, 2...0, 4) мкм] грамотрицательная палочковидная бактерия, преимущественно в форме кокко-бактерии. Красители воспринимает плохо, без жгутиков, спор не образует, но формирует капсулу (рис. 101). Из-за мелких размеров возбудителя его микроскопическое обнаружение затруднительно.
Выделение и идентификация культуры возбудителя. Возбудитель Среда Френсиса: к МПА (рН 7, 3) добавляют 0, 1 % цистина, 1 % глюкозы, кипятят несколько минут, охлаждают до 50 º С, добавляют 10 % дефибринированной стерильной крови кролика. Среда Емельяновой: в рыбно-дрожжевой агар вносят 0, 1 % цистина, 1 % глюкозы, агар охлаждают до 45 °С и добавляют 10 % стерильной дефибринированной крови. Посевы культивируют 24...48 ч. Возбудитель формирует мелкие, круглые, выпуклые, с ровными краями, гладкой блестящей поверхностью, беловатые колонии (рис. 102). Из подозрительных колоний готовят мазки, окрашивают, микроско-пируют. В препаратах из культуры в отличие от препаратов из нативного материала клетки возбудителя в основном не кокковидной, а палочковидной формы.
Рис. 102. Колонии F. tularensis (х7)
У культур с типичными для F. tularensis культурально-морфо-логическими признаками исследуют ферментативные свойства (табл. 31).
Выделенную культуру дополнительно идентифицируют с ту-ляремийной иммунной сывороткой в серологических реакциях (РА, ИФА, РП, РИГА). Биопроба. Выделить культуру F. tularensis посевом на питательные среды удается не всегда. Более эффективен метод заражения белых мышей или морских свинок тканевой суспензией подкожно или внутрибрюшинно по 0, 5 мл. Практикуют проведение 2...3 «слепых» пассажей на чувствительных лабораторных животных. Зараженные животные погибают на 3...5-е сутки, иногда позднее (8... 12-е сутки). У павших животных обнаруживают в паренхиматозных органах некротические очажки. Из органов путем посева на питательные среды выделяют культуру возбудителя. ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ 1. Приготовить и окрасить по методу Грама (Козловского) мазки из инактивированных клеток бруцелл, F. tularensis. Описать культуральные и морфологические свойства возбудителей. 2. Исследовать в пробирочной РА и роз-бенгал-тесте сыворотки крови от здоровых и больных бруцеллезом животных (крупный рогатый скот). 3. Освоить технику постановки и учета результатов кольцевой реакции с молоком. 4. Ознакомиться с биопрепаратами для специфической профилактики и диагностики бруцеллеза. Контрольные вопросы 1. Какой материал направляют в лабораторию для бактериологического исследования на бруцеллез и туляремию? 2. В чем состоит бактериологическое исследование на бруцеллез и туляремию? 3. Как ставят биопробу на бруцеллез и туляремию? 4. Какие методы применяют для серологической диагностики бруцеллеза? 5. Какие выпускают вакцины против бруцеллеза?
Тема 33 ЛАБОРАТОРНАЯ ДИАГНОСТИКА ПАСТЕРЕЛЛЕЗА, ГЕМОФИЛЕЗНОГО ПОЛИСЕРОЗИТА И АКТИНОБАЦИЛЛЕЗНОЙ ПНЕВМОНИИ СВИНЕЙ. БИОПРЕПАРАТЫ Цель занятий. Ознакомить студентов с лабораторной диагностикой пастереллеза, гемофилезного полисерозита и актинобациллезной пневмонии свиней, основными свойствами возбудителей, биопрепаратами. Оборудование и материалы. Культуры P. multocida в МПБ, на МПА, демонстрация — штативы с тестами, характеризующими видовые ферментативные признаки P. multocida (включая биовары), культуры A. pleuropneumoniae и Н. parasuis на кровяном МПА в чашках Петри с феноменом сателлитного роста, трупы мышей, павших после заражения P. multocida, пипетки Пастера, красители для окраски по Граму, Гинсу, демонстрация — чашки Петри с феноменом подавления роста культуры P. multocida серовара А в присутствии S. aureus, пробирки с отрицательной и положительной трипафлавиновой пробой с культурами P. multocida сероваров А и D, МПА и МПБ в пробирках.
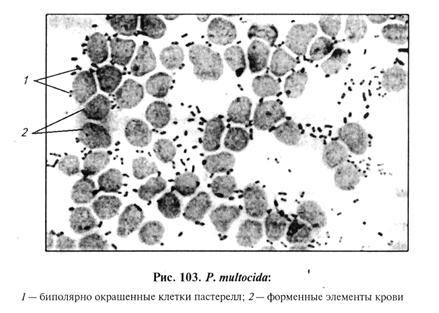
МЕТОДИЧЕСКИЕ УКАЗАНИЙ Пастереллез (геморрагическая септицемия). Инфекционная болезнь многих видов млекопитающих и птиц. При остром течении характеризуется септицемией, при подостром и хроническом — в основном поражением легких. Возбудитель — Pasteurella multocida (включает в себя три подвида), род Pasteurella, семейство Pasteurellaceae. Лабораторная диагностика пастереллеза основана на результатах бактериологического исследования. Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии, выделение чистой культуры посевом на культуральные среды и методом биопробы, идентификацию возбудителя по культурально-морфологическим, ферментативным, серологическим и патогенным свойствам. Материал для исследования. В лабораторию направляют селезенку, печень, почку, кровь сердца, лимфатические узлы, пораженные участки легких и регионарные лимфатические узлы. При необходимости материал консервируют 30%-м водным раствором глицерина, трубчатую кость заворачивают в марлю, пропитанную 5... 10%-м раствором формалина. Микроскопия препаратов из исходного материала. Мазки-отпечатки окрашивают по Граму и одним из методов для выявления капсулы. Пастереллы представляют собой грамотрицательные короткие палочковидные бактерии размером (0, 3...2) х (0, 2...0, 3) мкм, без спор и жгутиков, образуют капсулу. Возбудитель в препарате из материала обнаруживают в форме мелких (0, 3x1, 5 мкм) грамотрицательных коротких палочковидных капсулообразующих бактерий с закругленными концами вплоть до коккобактерий. При окраске синькой Леффлера бактериальные клетки более интенсивно окрашены в концевых частях (биполярная окраска). Клетки располагаются единично, попарно, короткими цепочками (рис. 103).
Выделение и идентификация культуры возбудителя. Возбудитель — факультативный анаэроб, температурный оптимум 37 °С (диапазон 25...40 °С), штаммы птиц растут при 42 º С, рН 7, 2...7, 4. Материал засевают на МПА, в МПБ, лучше — на кровяной или сывороточный МПА, так как нередко возбудитель в первичных посевах плохо растет или не растет на простых питательных средах. Посевы инкубируют в течение 24...48 ч, при отсутствии роста—в течение 4...5 сут. На плотных питательных средах пастереллы формируют мелкие, пучке света колонии (S-форма) диаметром 1...3мм (рис. 104); возможно появление крупных, слизистых (М-форма) или шероховатых (R-форма) колоний. Культуры серовара А образуют крупные (диаметр более 3 мм) слизистые колонии. Гемолитическая активность у P. multocida не выражена. В МПБ возбудитель растет с равномерным помутнением среды и образованием на дне пробирки слизистого осадка, поднимающегося при встряхивании в виде «косички», рост мукоидных штаммов сопровождается более интенсивным помутнением среды. У выделенных культур исследуют морфологию и тинкториальные свойства.
У культур с типичными культурально-морфологическими признаками исследуют ферментативные свойства. P. multocida расщепляет маннит, ксилозу, не разлагает мальтозу, образует индол, орнитиндекарбоксилазу, не синтезирует уреазу, не проявляет зависимости от V-ростового фактора ДПН (дифосфопиридин-нуклеотид). Внутри вида P. multocida дифференцируют по ферментативным особенностям на три подвида: P. multocida subsp. multocida ферментирует сорбит и не разлагает дульцит; P. multocida subsp. septica не ферментирует сорбит и дульцит; P. multocida subsp. gallicida ферментирует сорбит и дульцит. Серологические свойства изучают для дифференциации культур P. multocida по серовариантной принадлежности. Известны четыре серовара P. multocida (А, В, D, Е). В Европе эпизоотологическое значение имеют три серовара: В, D, А. Их идентифицируют в РНГА по капсульным антигенам, но чаще по присущим сероварам D и А особенностям химического состава клеток. Для этого устанавливают присутствие гиалуроновой кислоты в капсульном веществе и склонность бактерий агглютинировать в растворе трипафлавина. Трипафлавиновая проба: исследуемую культуру выращивают в бульоне Хоттингера (3 мл) в течение 24 ч, центрифугируют, затем удаляют 2, 5 мл культуральной жидкости, седимент ресуспенди-руют и добавляют 0, 5 мл водного раствора трипафлавина (1: 1000). Суспензию бактерий выдерживают при комнатной температуре 10...20 мин. Учет результатов: если суспензия стабильна, культуру относят к сероварам А или В; если сформирован осадок, культуру относят к серовару D. Тест на гиалуроновую кислоту в составе капсулы: исследуемую культуру засевают «штрихом» на агар Хоттингера в чашках Петри, затем высевают в виде прямой линии по диаметру чашки культуру S. aureus, способную продуцировать гиалуронидазу. Посевы инкубируют 18...24 ч, после чего просматривают колонии в косопроходящем свете. Культуральные свойства P. multocida се-роваров В, D, Е вблизи «штриха» S. aureus не изменяются, колонии культур серовара А (из-за расщепления гиалуронидазой стафилококка гиалуроновой кислоты в составе капсулы пастерелл) тусклые, серые или голубые, а не флуоресцирующие. Биопроба. Метод используют для выделения культуры возбудителя из исследуемого материала и определения вирулентности чистых культур. Исследуемым материалом от крупного рогатого скота, свиней, овец заражают белых мышей и кроликов; материалом, полученным от птиц, заражают голубей, кур, уток. Кроликов перед биопробой исследуют на пастереллоносительство: в течение трех дней вводят интраназально по две капли 0, 5%-го водного раствора бриллиантового зеленого. Появление гнойного истечения из носовой полости указывает на пастереллоносительство, и таких животных из опыта исключают. Суспензию тканевого материала, разведенную физиологическим раствором (1: 10), вводят кроликам подкожно по 0, 5 мл, белым мышам подкожно по 0, 2 мл, голубям внутримышечно по 0, 3 мл. При наличии в материале возбудителя животные погибают через 18...36 ч. Трупы животных подвергают бактериологическому исследованию. Биопрепараты. Вакцина эмульгированная против пастереллеза крупного рогатого скота представляет собой инактивированные 0, 25%-м раствором формальдегида клетки пастерелл серовара В в водно-масляной эмульсии. Контролируют на стерильность, безвредность (белые мыши, кролики) и иммуногенность на кроликах. Кроме того, готовят эмульгированные вакцины против пастереллеза свиней, кроликов, нутрий.
|