Экспериментальные и расчетные данные. Формула соли Номер раствора Концентрация соли, моль/дм3 Значение рН Kг расчетное экспериментальное
Обработка экспериментальных данных Часть 1. Определение среды растворов различных солей
Опыт 1. Ответить на поставленные вопросы. Написать уравнения диссоциации данных солей, указать среду растворов. Какой вид гидролиза происходит в каждом случае? Опыт 2. Ответить на поставленные вопросы. Составить ионные и молекулярные уравнения реакций гидролиза для данных солей, указать рН среды. Опыт 3. Составить ионные и молекулярные уравнения реакций гидролиза для данных солей. Указать среду растворов. Опыт 4. Ответить на поставленные вопросы. Составить ионное и молекулярное уравнения реакции, учитывая, что гидролиз протекает необратимо. Часть 2. Смещение гидролитических равновесий
Опыт 5. Смещение равновесие под действием температуры 1.Исходя из концентрации раствора, вычислить значение константы гидролиза K г по формуле (5) при трех температурах. Значение константы диссоциации уксусной кислоты принять равным 2. По уравнению (6) рассчитать рН раствора при данных температурах и сравнить его с опытными значениями рН. 3. Расчетные данные занести в табл. 5. 4. Составить ионное и молекулярное уравнения реакции гидролиза соли. 5. Заполнить метрологическую карту средств измерения (см. прил. 1) и сформулировать выводы. Опыт 6. Смещение равновесия при изменении концентрации раствора 1. Исходя из типа гидролиза, которому подвергается соль, вычислить значение константы гидролиза K г, используя формулу (5) или (7). Значение константы диссоциации слабого электролита дано в прил. 4. 2. Рассчитать рН растворов №1, 2 и 3, используя формулу (6) или (7). 3. Составить ионное и молекулярное уравнение реакции гидролиза соли. 4. Заполнить метрологическую карту средств измерения (см. прил. 1) и сформулировать выводы.
|

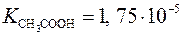 , а значение K в дано в прил. 3.
, а значение K в дано в прил. 3.


