Порядок выполнения работы. Приборы и реактивы: штатив с пробирками; 0,5 М растворы: гидроксида аммония, сульфата меди (II), хлорида меди (II)
Приборы и реактивы: штатив с пробирками; 0, 5 М растворы: гидроксида аммония, сульфата меди (II), хлорида меди (II), сульфата никеля (II), хлорида никеля (II), трихлорида железа, сульфата железа (II), родонида аммония (или калия), нитрата ртути (II), йодида калия, хлорида кобальта (II), железоаммонийных квасцов, гидроксида калия, хлорида бария, сульфида аммония, оксалата аммония, гексацианоферрата (II) калия, гексацианоферрата (III) калия.
Х о д р а б о т ы
Получение катионных комплексных соединений Опыт 1. Налить в пробирку 8–10 капель раствора сульфата или хлорида меди (II) и добавить по каплям раствор гидроксида аммония до образования зеленовато-голубого осадка основной соли (CuOH)2SO4 или CuOHCl. При последующем добавлении раствора аммиака наблюдать растворение осадка и получение окрашенного раствора комплексной соли [Cu(NH3)4]SO4 или [Cu(NH3)4]Cl2. Опыт 2. Внести в пробирку 8–10 капель раствора сульфата или хлорида никеля (II) и добавить по каплям раствор аммиака. Обратить внимание на происходящие изменения, связанные с первоначальным образованием осадка основной соли NiOHCl или (NiOH)2SO4 с последующим растворением полученного осадка в избытке аммиака и образованием окрашенного раствора комплексной соли [Ni(NH3)4]Cl2 или [Ni(NH3)4]SO4.
Получение анионных комплексных соединений Опыт 3. Внести в пробирку 10 капель раствора хлорида железа (III) и прибавить по каплям раствор роданида аммония или роданида калия. Что наблюдаете? К полученному раствору роданида железа (III) прилить раствор фторида натрия или аммония. Наблюдать исчезновение окраски раствора вследствие образования комплексного соединения: гексафтороферрата (III) натрия или аммония. Опыт 4. Внести в пробирку 6–8 капель нитрата ртути (II) и добавить по каплям раствор йодида калия до образования осадка
Различие между простыми и комплексными ионами Опыт 5. Налить в пробирку 8–10 капель раствора хлорида железа (III) и прибавить по каплям раствор роданида аммония или роданида калия до появления кроваво-красного окрашивания раствора, свидетельствующего о наличии в растворе ионов Fe3+. В другую пробирку внести раствор K3[Fe(CN)6] и прибавить к нему несколько капель раствора роданида калия (или аммония). Образуется ли при этом раствор темно-красного цвета, свидетельствующий о присутствии в растворе иона Fe3+? Разрушение комплексных ионов при разбавлении растворов Опыт 6. Налить в пробирку 10–12 капель раствора хлорида кобальта (II) и прибавить несколько капель концентрированного раствора роданида калия (или аммония). Наблюдать появление окрашенного раствора вследствие образования комплексного соединения K2[Со(CNS)4]. Полученный раствор разбавить водой до появления первоначальной розовой окраски, характерной для ионов Со2+.
Диссоциация двойных солей Опыт 7. В три пробирки внести по 10–12 капель раствора железоаммонийных квасцов NH4Fe(SO4)2. В первую пробирку прилить несколько капель раствора роданида калия (или аммония). Окрашивание раствора в темно-красный цвет указывает на присутствие в растворе ионов Fe3+. Во вторую пробирку добавить избыток раствора гидроксида калия или натрия, содержимое пробирок нагреть. Выделение аммиака свидетельствует о наличии в первоначальном растворе ионов NH
Разрушение комплексного иона осаждением комплексообразователя Опыт 8. В две пробирки внести по несколько капель сульфата меди. В первую пробирку добавить такой же объем раствора оксалата аммония, а во вторую – сульфида аммония. Отметить цвет появившихся в пробирках осадков. Пробирки с осадками сохранить в качестве контрольных образцов. В двух других пробирках получить комплексное соединение меди: прибавить к 6–8 каплям раствора сульфата меди (II) раствор аммиака до растворения образовавшегося вначале осадка основной соли меди. Далее в одну из пробирок с комплексной солью прилить раствор оксалата аммония, а в другую – раствор сульфида аммония. В каком случае выпадает осадок? Полученный осадок сравнить с осадками в контрольных пробирках.
Комплексные соединения в реакциях обмена Опыт 9. В пробирку внести несколько капель раствора гексацианоферрата (II) калия, затем добавить несколько капель раствора хлорида железа (III). Наблюдать образование осадка комплексной соли железа (III) (берлинской лазури). Эта реакция является качественной для иона Fe3+. Налить в пробирку несколько капель раствора гексацианоферрата (III) калия и добавить несколько капель раствора сульфата железа (II). Наблюдать образование осадка комплексной соли железа (II) (турнбулевой сини). Эта реакция является качественной для иона Fe2+.
Обработка экспериментальных данных Опыт 1. Написать уравнения реакций в молекулярном и ионно-молекулярном виде. Указать цвет осадков и растворов. Назвать полученные соединения. Опыт 2. Составить уравнения реакций в молекулярном и ионно-молекулярном виде. Описать цвета осадков и растворов. Назвать полученные соединения. Опыт 3. Написать уравнения реакций в молекулярной и ионно-молекулярной форме, указать цвета полученных соединений. Опыт 4. Составить уравнения реакций в молекулярном и ионно-молекулярном виде. Указать цвета осадка и раствора. Назвать продукты реакций. Указать, к какому типу относится полученное комплексное соединение. Опыт 5. Написать уравнение реакции взаимодействия раствора хлорида железа (III) с роданидом аммония. Составить уравнение диссоциации комплексного соединения и выражение константы нестойкости комплексного иона. Сделать вывод о различии между простыми и комплексными ионами. Опыт 6. Написать уравнение реакции получения комплекса. Назвать полученный комплекс, определить, к какому классу его можно отнести. Составить уравнение диссоциации комплексного соединения и выражение константы нестойкости комплексного иона. Как влияет концентрация раствора на устойчивость комплексного соединения? Опыт 7. Составить в молекулярной и ионно-молекулярной форме реакции взаимодействия двойной соли с растворами: роданида аммония, гидроксида калия (или натрия), хлорида бария. Написать уравнение диссоциации двойной соли. Сделать вывод о различии между комплексными и двойными солями. Опыт 8. Записать реакцию образования аммиачного комплекса меди (II). Составить уравнение реакции взаимодействия комплексной соли с сульфидом аммония. Что происходит с комплексным ионом в каждом случае? Объяснить, почему не выпал осадок в случае прибавления оксалата аммония. При объяснении воспользоваться значениями произведения растворимости образующихся осадков (см. прил. 2). Константу нестойкости иона [Co(NH3)6]2+ принять равной Опыт 9. Записать уравнения реакций в молекулярной и ионно-молекулярной форме. Назвать полученные комплексные соединения.
|

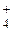 . В третью пробирку прибавить несколько капель раствора хлорида бария. Образование белого осадка свидетельствует о присутствии в исходном растворе ионов SO
. В третью пробирку прибавить несколько капель раствора хлорида бария. Образование белого осадка свидетельствует о присутствии в исходном растворе ионов SO 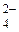 .
.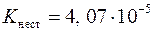 .
.


