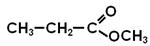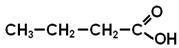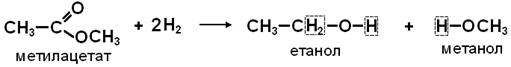Застосування
Мурашиний альдегід – 40 % водний розчин формальдегіду застосовують під назвою „формалін” як дезінфікуючий та дублячий засіб, консервант анатомічних препаратів. У промисловості використовують у виробництві фенолоформальдегідних смол. Оцтовий альдегід використовують для одержання оцтової кислоти. Ацетон застосовується як розчинник органічних речовин і як вихідна речовина в синтезі деяких лікарських препаратів, наприклад йодоформу. Йодоформ застосовують як антисептичний засіб в стоматології, а також у формі присипок і мазей для лікування інфікованих ран і виразок.
§13.4. Карбоксильні сполуки 13.4.1. Карбонові кислоти
Загальна формула карбонових кислот: Класифікація карбонових кислот Залежно від природи радикала, пов'язаного з карбоксильною групою, кислоти ділять на:
Число карбоксильних груп визначає основність кислот:
Загальна формула насичених одноосновних кислот: СnH2n+1COOH ( або СnH2nO2). Номенклатура Поширені тривіальні назви. За правилами IUPAC до назви вуглеводня додають " -ова кислота ".
Ізомерія карбонових кислот 1. Для аліфатичних кислот – ізомерія вуглеводневого радикалу. 2. Для ароматичних - ізомерія положення замісника при бензольному кільці. 3. Міжкласова ізомерія з естерами (наприклад, CH3COOH і HCOOCH3).
Одержання 1) окиснення первинних спиртів і альдегідів киснем в присутності каталізаторів, KMnO4; K2Cr2O7:
2) промисловий синтез мурашиної кислоти: a) каталітичне окиснення метану 2CH4 + 3O2 –– t°, кат ® 2H–COOH + 2H2O б) нагріванням оксиду вуглецю (II) з гідроксидом натрію CO + NaOH –– p; 200°C ® H–COONa ––H2SO4® H–COOH 3) промисловий синтез оцтової кислоти: a) каталітичне окиснення бутану 2CH3–CH2–CH2–CH3 + 5O2 –– t°, кат ® 4CH3COOH + 2H2O б) нагріванням суміші оксиду вуглецю (II) і метанолу на каталізаторі під тиском CH3OH + CO ® CH3COOH 4) окисненням гомологів бензолу синтезують ароматичні кислоти: 5 толуол бензойна кислота 5) гідроліз функціональних похідних (складних ефірів, ангідридів, галогенангідридів, амідів). СH3COOС2Н5 –– t°, Н2О ® СH3COOН + С2Н5ОН етилацетат етанова кислота етанол
Хімічні властивості 1. Через зсув електронної густини від гідроксильної групи O–H до сильно поляризованої карбонільної групи C=O молекули карбонових кислот здатні до електролітичної дисоціації: R–COOH «R–COO- + H+ Сила карбонових кислот у водному розчині невелика. 2. Карбонові кислоти володіють властивостями, характерними для мінеральних кислот. Вони реагують з активними металами, основними оксидами, основами, солями слабких кислот: 2СH3COOH + Mg ® (CH3COO)2Mg + H2 2СH3COOH + СaO ® (CH3COO)2Ca + H2O H–COOH + NaOH ® H–COONa + H2O 2СH3CH2COOH + Na2CO3 ® 2CH3CH2COONa + H2O + CO2 СH3CH2COOH + NaHCO3 ® CH3CH2COONa + H2O + CO2 Карбонові кислоти слабші за багато сильних мінеральних кислот (HCl, H2SO4 і т.д.) і тому витісняються ними з солей: СH3COONa + H2SO4(конц.) ––® CH3COOH + NaHSO4 3. Утворення функціональних похідних: a) при взаємодії із спиртами (у присутності концентрованої H2SO4) утворюються складні ефіри. Утворення складних ефірів при взаємодії кислоти і спирту у присутності мінеральних кислот називається реакцією ЕСТЕРИФІКАЦІЇ (ester з латинського " ефір"). Дану реакцію розглянемо на прикладі утворення метилового ефіру оцтової кислоти з оцтової кислоти і метилового спирту:
Загальна формула складних ефірів (естерів ) Зворотною реакцією є гідроліз складного ефіру (ОМИЛЕННЯ):
метилацетат етанова кислота метанол Як видно, процес етерифікації оборотний:
При настанні хімічної рівноваги в реакційній суміші знаходитимуться як початкові, так і кінцеві речовини. Каталізатор (іони водню) – однаково прискорюють пряму і зворотну реакції, тобто йде досягнення рівноваги. Щоб зсунути рівновагу у бік утворення естеру, слід брати в надлишку початкові кислоту або спирт, або видаляти один з продуктів реакції зі сфери взаємодії – наприклад, відганяючи естер або зв'язуючи воду водовіднімаючими засобами. б) при дії водовіднімаючих реагентів в результаті міжмолекулярної дегідратації утворюються ангідриди:
оцтовий ангідрид c) при обробці карбонових кислот п'ятихлористим фосфором одержують хлорангідриди
хлорангідрид оцтової кислоти Гідроліз всіх функціональних похідних карбонових кислот (ангідридів, хлорангідридів, складних ефірів і ін.) приводить в кислому середовищі до початкових карбонових кислот, а в лужному середовищі – до їх солей. 4. Галогенування. При дії галогенів (у присутності червоного фосфору) утворюються a-галогензаміщені кислоти:
a- Галогензаміщені кислоти – більш сильні кислоти, ніж карбонові, за рахунок електроноакцепторних властивостей атома галогену.
До ненасичених карбонових кислот відносяться карбонові кислоти, які містять у вуглеводному радикалі кратний зв'язок. В номенклатурі ненасичених кислот широко використовують тривіальні назви. За ІЮПАК назви ненасичених кислот утворюють аналогічно насиченим, використовуючи суфікс –ен для позначення подвійного зв'язку і суфікси –ин(ін) для позначення потрійного. Реакційна здатність ненасичених монокарбонових кислот зумовлена наявністю в їх структурі карбоксильної групи, зокрема, вони утворюють солі, галогенангідриди, ангідриди, естери, аміди. По кратному зв'язку у вуглеводневому радикалі ненасичені кислоти мають властивості алкенів (алкінів). ВИЩІ КАРБОНОВІ КИСЛОТИ були виділені з жирів, тому одержали назву жирних. Ці сполуки (ВЖК) входять до складу багатьох ліпідів – групи речовин, що містяться в тваринних і рослинних тканинах, що виконують ряд важливих функцій, не розчинних у воді, але розчинних в малополярних розчинниках. ВЖК, в більшості, монокарбонові кислоти з нерозгалуженим вуглецевим ланцюгом і парним числом атомів Карбону (частіше всього 16 і 18 атомів). ВЖК проявляють хімічні властивості, характерні для карбонових кислот взагалі. У ліпідах організму людини ВЖК можуть бути представлені насиченими (стеаринова, пальмітинова) і ненасиченими (олеїнова, лінолева, ліноленова, арахідонова) кислотами, рідше – циклічними і гідроксикислотами. Особливо важлива роль поліненасичених лінолевої і ліноленової кислот як сполук, незамінних для людини. Вони сприяють зниженню в крові холестеролу – одного з чинників розвитку атеросклерозу. Застосування Мурашина кислота – в медицині, в бджільництві, в органічному синтезі, при отриманні розчинників і консервантів; як сильний відновник. Оцтова кислота – в харчовій і хімічній промисловості (виробництво ацетилцелюлози, з якої одержують ацетатне волокно, органічне скло, кіноплівку; для синтезу фарбників, медикаментів і складних ефірів). Масляна кислота – для отримання ароматизуючих добавок, пластификаторів і флотореагентів. Щавлева кислота – в металургійній промисловості (видалення окалини). Стеаринова C17H35COOH і пальмітинова кислоти C15H31COOH – як поверхнево-активні речовини, змащувальні матеріали в металообробці. Олеїнова кислота C17H33COOH – флотореагент і збирач при збагаченні руд кольорових металів. ДИКАРБОНОВИМІ КИСЛОТАМИ називають похідні вуглеводнів, які містять в своєму складі дві карбоксильні групи. НО– У номенклатурі дикарбонових кислот застосовують тривіальні назви. За номенклатурою ІЮПАК назви дикарбонових кислот утворюють з назв відповідних вуглеводнів з додаванням префікса – ди -, суфікса – ова і слова кислота. COOH ½ COOH етандіова кислота (щавлева кислота) Ізомерія дикарбонових кислот обумовлена різною структурою вуглецевого скелету. Одержують дикарбонові кислоти тими ж методами, що і монокарбонові, використовуючи як початкові речовини біфункціональні сполуки. За хімічними властивостями дикарбонові кислоти схожі до монокарбонових, але утворюють два ряди похідних (дисоціюють ступінчасто – утворюють солі кислі і середні, естери повні і неповні, галогенангідриди та аміди). Крім того, дикарбоновв кислоти проявляють ряд специфічних властивостей: а) при нагріванні декарбоксилюються по одній карбоксильній групі і перетворюються на монокарбонові; б) починаючи з янтарної кислоти при нагріванні утворюють циклічні ангідриди (янтарний та глутаровий, у випадку нагрівання гександіової кислоти - циклопентанон). Ненасичені дикарбонові кислоти містять в своєму складі дві карбоксильні групи і кратний вуглець-вуглецевий зв'язок. Представниками даних кислот є малеїнова і фумарова кислоти, які є геометричними цис- і транс- ізомерами. Так, малеїнова і фумарова кислоти відрізняються розташуванням карбоксильних груп відносно площини, яка проходить через середину π -звязку (рис.6)
а) малеїнові кислота (цис-ізомер), б) фумарола кислота (транс-ізомер) За хімічними властивостями ці кислоти схожі до насичених мононокарбонових кислот і ненасичених вуглеводнів. Ароматичні дикарбонові кислоти містять дві карбоксильні групи безпосередньо сполучені з ароматичним ядром. Найважливішими представниками є фталева кислота і її ізомери. Естери
Загальна формула СnH2nO2 – або
Номенклатура Естери можна розглядати як похідні кислот, в яких атом гідрогену заміщений на радикал. Назву естеру записують одним словом: • естери, утворені мінеральними кислотами
• естери, утворені спиртами та карбоновими кислотами
(метилацетат, метиловий естер оцтової кислоти)
Види ізомерії 1) Ізомерія карбонового скелету.
2) Міжкласова ізомерія (з карбоновими кислотами).
Фізичні властивості Естери нижчих карбонових кислот та спиртів – леткі рідини, мають приємний фруктовий запах, малорозчинні у воді, добре розчинні в органічних розчинниках, легкозаймисті, на повітрі горять з утворенням СО2 і Н2О. Між молекулами естерів відсутній водневий зв'язок. Наприклад, метилпентаноат має запах вишень, метилетаноат – рому, етилпентаноат – бананів, бутилетаноат – абрикосів, бутилбутаноат – ананасів, ізопентилетаноат – яблук. Естери вищих карбонових кислот та спиртів – високомолекулярні речовини. Наприклад, бджолиний віск складається з мірицилпальмітату С15Н31СООС31Н63.
Поширення в природі. Містяться у квітах, фруктах, ягодах, визначають їх специфічний запах. Бджолиний віск переважно складається із складних ефірів вищих жирних кислот і високомолекулярних одноатомних спиртів.
Одержання Реакція ЕСТЕРИФІКАЦІЇ – кислота + спирт.
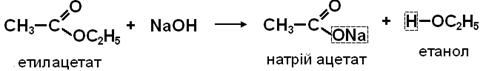
Хімічні властивості 1. ГІДРОЛІЗ (в кислому середовищі) або ОМИЛЕННЯ (в лужному середовищі). Ця реакція є зворотною щодо реакції ЕСТЕРИФІКАЦІЇ. Гідроліз у кислому середовищі оборотний.
У лужному середовищі утворюється сіль і гідроліз стає необоротним.
2. ГІДРУВАННЯ - взаємодія з воднем:
Застосування 1. Як розчинник для лаків і фарб. 2. Для виготовлення штучних фруктових есенцій та ароматизаторів. 3. У виробництві парфумів. 4. У виробництві СМЗ і вибухових речовин. Генетичний зв’язок між вуглеводнями, спиртами, альдегідами і кислотами Між різними класами органічних сполук існує генетичний зв’язок. Це означає, що із одної органічної сполуки можна отримати іншу і т.д. Знання взаємних перетворень речовин має величезне практичне значення, оскільки ці перетворення лежать в основі різноманітних синтезів, які можна вести цілеспрямовано, передбачивши продукти реакції і спрямовуючи ці реакції в потрібний бік.
|

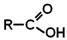
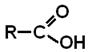


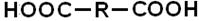
 + 6KMnO4 + 9H2SO4 –– t° ® 5
+ 6KMnO4 + 9H2SO4 –– t° ® 5  + 3K2SO4 + 6MnSO4 + 14H2O
+ 3K2SO4 + 6MnSO4 + 14H2O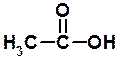 оцтова кислота + HO–CH3 метиловый спирт ®
оцтова кислота + HO–CH3 метиловый спирт ®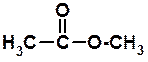 метиловиий ефір оцтової кислоти + H2O
метиловиий ефір оцтової кислоти + H2O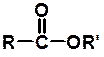 , де R і R' – вуглеводневі радикали в складних ефірах.
, де R і R' – вуглеводневі радикали в складних ефірах. –– (P2O5) ®
–– (P2O5) ® 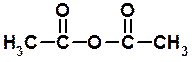 + H2O
+ H2O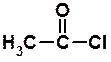 + POCl3 + HCl
+ POCl3 + HCl –R–
–R– 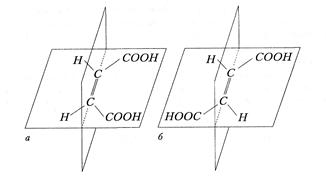 Рис.6. Геометричні ізомери:
Рис.6. Геометричні ізомери: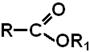 , де
, де  залишок кислоти,
залишок кислоти,  - залишок спирту.
- залишок спирту.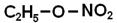 - етилнітр АТ
- етилнітр АТ - метилетан ОАТ
- метилетан ОАТ