Крохмаль
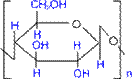
Будова молекули (розгалужений ланцюг)
Фізичні властивості Крохмаль – це аморфний білий порошок, що складається з дрібних зерен, не розчинний в холодній воді. Хімічні властивості Крохмаль легко піддається гідролізу: при нагріванні у присутності сірчаної кислоти утворюється глюкоза. (C6H10O5)n(крохмаль) + nH2O –– H2SO4, t° ® nC6H12O6(глюкоза) Залежно від умов проведення реакції гідроліз може здійснюватися ступенево з утворенням проміжних продуктів. (C6H10O5)n(крохмаль)® (C6H10O5)m(декстрини (m< n))® xC12H22O11(мальтоза)® nC6H12O6(глюкоза)
þ Якісною реакцією на крохмаль є його взаємодія з йодом – спостерігається інтенсивне синє забарвлення. Таке забарвлення з'являється, якщо на зріз картоплі або скибочку білого хліба помістити краплю розчину йоду. L Крохмаль не вступає в реакцію " срібного дзеркала".
Знаходження в природі Крохмаль утворюється в рослинах при фотосинтезі і відкладається у вигляді " резервного" вуглеводу в корінні, бульбах і насінні. Наприклад, зерна рису, пшениці і інших злаків містять 60-80% крохмалю, картопля – 15-20%. Споріднену роль в тваринному світі виконує полісахарид глікоген, що " запасається", в основному, в печінці. Крохмаль є цінним харчовим продуктом. Для полегшення його засвоєння продукти, що містять крохмаль, піддають термообробці, тобто картоплю і крупи варять, хліб печуть. Застосування У харчовій промисловості крохмаль використовується при виробництві ковбасних, кондитерських і кулінарних виробів. Застосовується також для отримання глюкози, при виготовленні паперу, текстильних виробів, клеїв, лікарських засобів і т.д. Целюлоза (клітковина) Будова молекули (лінійний ланцюг)
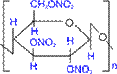
Як і у крохмалю, структурною одиницею целюлози є D- глюкопіраноза. Проте, від крохмалю целюлоза відрізняється b -конфігурацією глікозидних зв'язків між циклами і строго лінійною будовою.
Фізичні властивості Тверда волокниста речовина, нерозчинна у воді, нерозчинна у органічних сполуках. Хімічні властивості 1. Реакції естерифікації (утворення складних ефірів). Найбільше практичне значення мають реакції з азотною кислотою і оцтовим ангідридом.
Піроксилін після відповідної обробки перетворюється на бездимний порох. Залежно від умов нітрування можна одержати динітрат целюлози, він так само використовується при виготовленні пороху і твердих ракетних палив, на його основі виготовляють целулоїд. При взаємодії целюлози з оцтовим ангідридом у присутності оцтової і сірчаної кислот утворюється триацетилцелюлоза.
Триацетилцелюлоза (або ацетилцелюлоза) є цінним продуктом для виготовлення негорючої кіноплівки і ацетатного шовку.
2. Як і крохмаль, целюлоза при кислотному гідролізі дає глюкозу. (C6H10O5)n (целюлоза) + nH2O –– H2SO4, t° ® nC6H12O6 (глюкоза) R Целюлоза не дає реакції " срібного дзеркала". Знаходження в природі ЦЕЛЮЛОЗА – найпоширеніший рослинний полісахарид. Вона має велику механічну міцність. Деревина містить 50-70% целюлози, бавовна є майже чистою целюлозою. b- Глікозидний зв'язок не руйнується травними ферментами людини, тому целюлоза не може служити їжею (!), хоча в певній кількості є необхідною для нормального харчування речовиною. В шлунках жуйних тварин є ферменти, що розщеплюють целюлозу, тому такі тварини використовують клітковину як компонент їжі.
Застосування 1. Продукт горіння, енергія. 2. Як будівельний матеріал, виготовлення меблів. 3. Виробництво тканин (штучного шовку). 4. Добування деревного вугілля, метанолу, ацетону. 5. Добування тринітроцелюлози, з якої виготовляють вибухові речовини. 6. Виготовлення паперу.
Розділ 15. НІТРОГЕНВМІСНІ ОРГАНІЧНІ СПОЛУКИ
§15.1. Нітросполуки
Загальна формула CnH2n+1NО2, R–NО2.
Класифікація і номенклатура Залежно від числа нітрогруп розрізняють
Назви нітросполук утворюють від назв вуглеводнів з додаванням префікса –нітро.
Одержання 1). НІТРУВАННЯ насичених вуглеводнів (реакція М.І.Коновалова):
2) НІТРУВАННЯ ароматичних сполук – дією нітруючої суміші (концентрованих нітратної НNО3та сульфaтної Н2SО4 кислот):
Тринітротолуен відомий, як вибухова речовина.
3) Реакцією галогенопохідних алканів з аргентум (І) нітритом:
Хімічні властивості 1) ВІДНОВЛЕННЯ нітросполук (одержують відповідні аміни):
2) ВІДНОВЛЕННЯ нітроаренів (нітробензену) до феніламіну (аніліну) за реакцією М.Зініна:
Застосування Нітроалкани застосовують як розчинники жирів та воску. З нітробензену одержують анілін. Нітросполуки, які містять дві-три NO2-групи, застосовують як вибухові речовини.
§15.2. Аміни
Класифікація Залежно від числа радикалів розрізняють
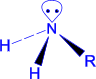
Атом азоту в NH3 і амінах знаходиться в стані sp3- гібридизації. Три такі орбіталі перекриваються з 1s- орбіталями атомів водню або sp3- орбіталями атома вуглецевого радикалу, дають три s- зв'язки, а четверта sp3- орбіталь зайнята вільною електронною парою атома азоту.
Номенклатура При складанні назви перераховують радикали з додаванням закінчення " -амін":
Ізомерія 1. Ізомерія вуглецевого скелета (починаючи з бутиламіну). 2. Ізомерія положення аміногрупи (починаючи з пропіламину). Фізичні властивості Метиламін, диметиламін і триметиламін - гази; середні члени аліфатичного ряду - рідини; вищі - тверді речовини. Нижчі аміни добре розчинні у воді і мають різкий запах. Із збільшенням молекулярної маси збільшуються t° кип. і t° пл.; зменшується розчинність у воді. Одержання 1). АМІНОЛІЗ галогеналканів і галогенаренів: NН3 –– С2Н5Br ® [С2Н5NН3]+Br- –– NН3 ® С2Н5NН2 + NН4Br C2H5NН2 –– С2Н5Br ® [(С2Н5)2NН2]+Br- –– NН3 ® (С2Н5)2NН + NН4Br (C2H5)2NН –– С2Н5Br ® [(С2Н5)3NН]+Br- –– NН3 ® (С2Н5)3N + NН4Br 2). ВІДНОВЛЕННЯ нітросполук (реакція Зініна).
Хімічні властивості ОСНОВНІ ВЛАСТИВОСТІ Основність амінів зумовлена здатністю атома азоту ПРИЄДНУВАТИ протон (Н+) до неподіленої пари електронів з утворенням катіона амонієвого типу. Основність амінів вимірюється константою рівноваги реакції гідратації: RNH2 + H2O «[RN+H3]OH- «[RN+H3] + OH- Ароматичні аміни (анілін, толуїдини і ін.) внаслідок сполучення неподіленої пари електронів атома азоту з p- електронами бензольного ядра є більш слабкими основами, ніж аміак і аліфатичні аміни.
1. Аміни реагують з мінеральними кислотами утворюючи солі амонієвого типу:
RR'NH + HCl ® [RR'NH2]+Cl- RR'R" N + HCl ® [RR'R" NH]+Cl-
2. Алкілування амінів галогеналканами приводить до утворення солей амонію. CH3NH2 + C2H5Br ®[CH3NH2C2H5]+Br -(метилетиламоній бромід)
Під дією лугів ці солі розкладаються до відповідних амінів, наприклад:
[СН3NH2СН2СН2CH3]+I-(метилпропіламоніййодид) + NaOH ®
3. Ацилування амінів похідними карбонових кислот (галогенангідридами, ангідридами) дає N- заміщені аміди:
4. Горіння. Аміни згоряють в кисні, утворюючи азот, вуглекислий газ і воду. 4CH3NH2 + 9O2 ® 4CO2 + 10H2O + 2N2 4C2H5NH2 + 15O2 ® 8CO2 + 14H2O + 2N2
Застосування Аміни використовують при отриманні лікарських речовин, фарбників і початкових продуктів для органічного синтезу. Гексаметилендіамін при поліконденсації з адіпіновою кислотою утворює поліамідні волокна §15.3. Амінокислоти
Загальна формула:
Залежно від взаємного розташування карбоксильної і аміногруп розрізняють α -, β -, γ - і т.д. амінокислоти.
Класифікація Залежно від природи радикала (R) – амінокислоти діляться на аліфатичні, ароматичні і гетероциклічні.
*Незамінні: α -амінокислоти Ізомерія · вуглецевого скелету · положенням функціональних груп, · для α -амінокислот характерна оптична (дзеркальна) ізомерія.
Всі α -амінокислоти, крім гліцину, оптично активні. Наприклад, аланін має один асиметричний (хіральний) атом вуглецю (відзначений зірочкою)
тобто, існує у вигляді оптично активних енантіомерів:
Всі природні α -амінокислоти відносяться до L– ряду.
Хімічні властивості 1) Кислотна (–COOH) і основна (–NH2) групи в молекулі амінокислоти взаємодіють одна з одною, утворюючи внутрішні солі (біполярні йони). Наприклад, для гліцину
2) α -амінокислоти є амфотерними сполуками ·утворюють солі з лугами (pеакція заміщення):
натрієва сіль гліцину ·утворюють солі з кислотами (реакція приєднання)
3) α -Амінокислоти вступають одна з одною в реакцію поліконденсації (реакція між СООН групою першої кислоти і NH2 групою другої кислоти). Продукти такої конденсації називаються ПЕПТИДАМИ. При взаємодії двох амінокислот утворюється дипептид:
При конденсації трьох амінокислот утворюється трипептид і т.д.
Застосування 1. У складі білків харчових продуктів людина отримує всі необхідні амінокислоти. 2. У медицині для харчування важкохворих і як ліки. §15.4. Пептиди. Білки
Умовно вважають, що пептиди містять в молекулі до 100 (відповідає молекулярній масі до 10000), а білки - понад 100 амінокислотних залишків (молекулярна маса від 10000 до декілька мільйонів).
Склад і будова молекули Усі білки містять Карбон, Гідроген, Оксиген і Нітроген. Більшість білків містять ще і Сульфур, деякі і Фосфор. До складу гемоглобіну входить Ферум, до білку щитовидної залози – Іод. Молекулярна маса білків – до кількох мільйонів. Білкова молекула – поліпептид містить від 2 до 100 амінокислотних залишків. Для білків (протеїнів) характерні чотири рівні просторової організації, які прийнято називати первинною, вторинною, третинною і четвертною структурами.
Поширення в природі Найважливіша складова частина живих організмів, білки входять до складу шкіри, рогових покривів, м’язової та нервової тканин. Хімічні властивості 1) ДЕНАТУРАЦІЯ – це втрата білком природної конформації, що супроводжується звично втратою його біологічної функції.
З погляду структури білка – це руйнування вторинної і третинної структур білка, зумовлене дією кислот, лугів, нагрівання, радіації і т.д. Первинна структура білка при денатурації зберігається. Денатурація може бути оборотною (так звана, ренатурація) і необоротною. Приклад необоротної денатурації при тепловій дії – згортання яєчного альбуміну при варці яєць.
2) ГІДРОЛІЗ БІЛКІВ – руйнування первинної структури білка під дією кислот, лугів або ферментів, що приводить до утворення α - амінокислот, з яких він був складений.
þ 3) Якісні реакції на білки: a) Біуретова реакція – фіолетове забарвлення при дії солей міді (II) в лужному розчині. Таку реакцію дають всі сполуки, що містять пептидний зв'язок. б) Ксантопротеїнова реакція – поява жовтого забарвлення при дії концентрованої азотної кислоти на білки, що містять залишки ароматичних амінокислот (фенілаланіну, тирозину).
|



 целюлоза
целюлоза
 тринітрат целюлози
ПІРОКСИЛІН
тринітрат целюлози
ПІРОКСИЛІН

 триацетилцелюлоза
триацетилцелюлоза
 1, 3, 5-тринітробензен
1, 3, 5-тринітробензен
 бензен
бензен
 нітробензен
нітробензен
 толуен
толуен
 2, 4, 6 – тринітротолуен
(тротил)
2, 4, 6 – тринітротолуен
(тротил)
 нітробензен
нітробензен
 феніламін, анілін
феніламін, анілін



 (ізопропіламін)
(ізопропіламін)
 (диметилетиламін)
(диметилетиламін)




 + 6[H] ®
+ 6[H] ®  + 2H2O
+ 2H2O

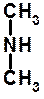



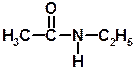
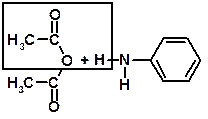




















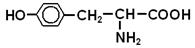
 біполярний йон
біполярний йон



 – α - спіраль.
– α - спіраль.




