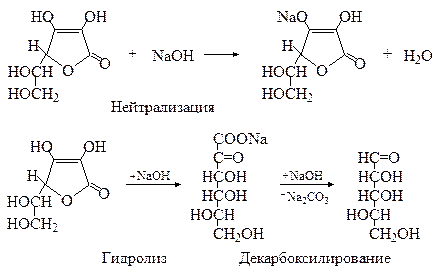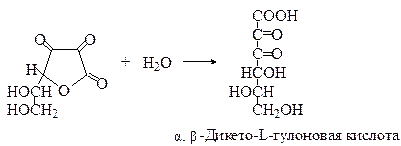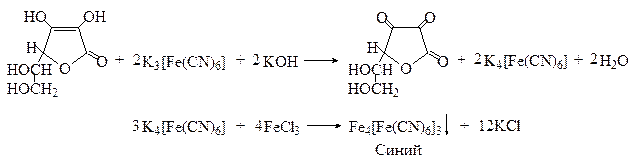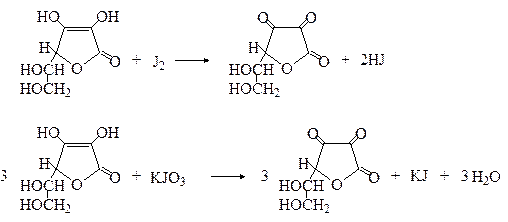ВИТАМИН С
Как видно из таблицы 5, витамин С - аскорбиновая кислота (рК а 4,04) является более сильной кислотой, чем уксусная кислота (рК а 4,75). Хотя аскорбиновая кислота является достаточно сильной одноосновной кислотой, количественно определять ее методом нейтрализации нецелесообразно. Это обусловлено тем, что наряду с реакцией нейтрализации, в некоторой степени в ходе титрования идет гидролиз лактонного кольца с образованием натриевой соли α-кето-L-гулоновой кислоты, которая далее легко декарбоксилируется, что приводит к завышенным результатам анализа.
Аскорбиновая кислота является сильным восстановителем. Она окисляется ионами серебра и меди, йодом, красной кровяной солью, нитратами, кислородом и др. При окислении аскорбиновой кислоты образуется дегидроаскорбиновая кислота. Окисление аскорбиновой кислоты кислородом легко происходит в нейтральной и щелочной среде, оно катализируется ионами тяжелых металлов (меди, железа, серебра). Глюкоза, глютаминовая кислота, флавоноиды, креатинин, стабилизируют аскорбиновую кислоту в растворах.
В организме дегидроаскорбиновая кислота вновь восстанавливается НАДН до аскорбиновой кислоты. Аскорбиновая и дегидроаскорбиновая кислоты являются коферментами ферментов оксидоредуктаз. Дегидроаскорбиновая кислота еще легче, чем аскорбиновая кислота, подвергается гидролизу с образованием α,β-дикето-L-гулоновой кислоты.
α-Кето- и α,β-дикето-L-гулоновые кислоты не обладают витаминной активностью. Гидролиз лактонного кольца аскорбиновой кислоты и её окисление являются причинами резкого снижения содержания аскорбиновой кислоты при кулинарной обработке продуктов. В кислой среде аскорбиновая кислота более устойчива к окислению и гидролизу, чем в щелочной. Для идентификации аскорбиновой кислоты используются реакции с красителями – метиленовым синим и 2,6-дихлорфенолиндофенолом. Реакция аскорбиновой кислоты с метиленовым синим весьма специфична и используется для открытия её в в растительных и животных продуктах. Реакция с 2,6-дихлорфенолиндофенолом применяется главным образом для количественного определения аскорбиновой кислоты в овощах, фруктах, ягодах и других растительных продуктах.
Для идентификации аскорбиновой кислоты применяют и красную кровяную соль, которая в щелочной среде восстанавливается аскорбиновой кислотой до желтой кровяной соли. После подкисления реакционной смеси и добавления раствора хлорида железа (III) образуется синий осадок берлинской лазури.
Аскорбиновая кислота восстанавливает даже такие слабые окислители как йод, соли ртути и серебра.
Титрование аскорбиновой кислоты 6-дихлорфенолиндофенолом (метод Тильманса) осуществляют в кислой среде в которой2,6-дихлорфенолиндофенол имеет розовую окраску а в щелочной среде – синюю.
Титрование неокрашенных кислых растворов аскорбиновой кислоты проводят раствором натриевой соли 2,6-дихлорфенолиндофенола, окрашенным в синий цвет, до появления розовой окраски реакционной смеси. Этот метод является безиндикаторным. Поскольку продукт восстановления 2,6-дихлорфенолиндофенола - 4-гидроксифенил-4-гидрокси-3,5-дихлорфениламин бесцветен, то появление в точке эквивалентности избытка титранта вызывает розовое окрашивание. При определении аскорбиновой кислоты в окрашенных смесях (ягоды, окрашенные овощи) к анализируемой смеси добавляют хлороформ и титруют раствором натриевой соли 2,6-дихлорфенолиндофенола до появления розовой окраски хлороформного слоя.
Для количественного анализа лекарственных средств - растворов, порошков, таблеток, субстанций аскорбиновой кислоты применяются йодометрический и йодатометрический методы анализа, в основе которых лежат приведенные ниже реакции.
Во все методах количественного анализа, основанных на окислении аскорбиновой кислоты, молярная масса эквивалента аскорбиновой кислоты равна половине её молекулярной массы (Э = М/2).
|