Используемые термодинамические понятия и величины
При изложении термодинамики растворов часто используют парциальные величины, которые характеризуют изменение экстенсивных свойств системы при добавлении бесконечно малого количества одного из компонентов. Так, парциальный мольный объем Ц определяется выражением:
где V- объем компонента i в смеси; ni,- - число молей компонента i. Парциальный мольный объем в общем случае не равен объему одного моля вещества. Если мы имеем смесь двух веществ, содержащую n1 моль компонента 1 и n2 моль компонента 2, то общий объем смеси должен быть выражен лишь через парциальные объемы:
и лишь для очень разбавленных растворов (n1 >> n2) можно записать:
Парциальная мольная функция Гиббса
Если смесь состоит из нескольких компонентов, количество каждого из которых определяется числом молей ni, то функция Гиббса системы равна:
Аналогично определяются понятия парциальной мольной энтальпии и энтропии:
Для парциальных величин справедливы все известные термодинамические соотношения. Согласно определению, для идеального раствора:
где Xi - мольная доля компонента i в смеси. После интегрирования (3.8) получаем:
где
где Δµi можно рассматривать как изменение химического потенциала растворителя при образовании раствора. Для реальных растворов в уравнении (3.9) вместо концентрации используется активность ai. Для предельно разбавленных растворов принимают, что активность равна концентрации. Наиболее общей термодинамической характеристикой раствора при постоянных температуре и давлении является функция Гиббса. Образование смеси из нескольких компонентов происходит в том случае, когда функция Гиббса системы уменьшается:
Величины ΔG, ΔН, ΔS называются соответственно функцией Гиббса, энтальпией и энтропией смешения, они определяются соотношениями:
где
|




 , называется химическим потенциалом и обозначается как µi:
, называется химическим потенциалом и обозначается как µi:




 является константой, называемой стандартным химическим потенциалом. Если уравнение (3.9) справедливо при всех значениях Хi то
является константой, называемой стандартным химическим потенциалом. Если уравнение (3.9) справедливо при всех значениях Хi то  , т.е. величина
, т.е. величина 


 ,
,  равны мольным значениям
равны мольным значениям 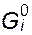 ; G, Н и S относятся к раствору.
; G, Н и S относятся к раствору.


