Теплопроводность
Теплопроводность – процесс передачи теплоты вследствие хаотического теплового движения молекул или атомов. Пусть имеются пластины А и В с постоянными температурами Т А и Т В, причем Т А > Т В (рис. 21). Молекулы газа, сталкиваясь с пластиной А, будут отражаться от нее с энергией EA = (3/2) kTA. Эти молекулы будут сталкиваться с другими молекулами и передавать им избыток своей кинетической энергии, что приводит к направленному переносу энергии в форме теплоты.
где c – коэффициент теплопроводности, dT/dz – градиент температуры (изменение температуры на единицу длины). Знак "минус" в формуле (37) указывает на то, что при теплопроводности количество теплоты переносится в направлении убывания температуры (градиент отрицателен). Из молекулярно-кинетической теории можно получить выражение коэффициента теплопроводности для газов:
где сV – удельная теплоемкость газа при постоянном объеме. Из сопоставления формул (33), (36) и (38) для коэффициентов явлений переноса следует, что они связаны следующими соотношениями:
9. Первое начало термодинамики
Внутренняя энергия термодинамической системы U включает кинетическую энергию всех внутренних движений частиц (поступательных, вращательных, колебательных) и потенциальную энергию их взаимодействия. Для идеального газа мы пренебрегаем потенциальной энергией. Поэтому внутренняя энергия идеального газа определяется кинетической энергией его молекул, а кинетическая энергия для данной массы газа зависит только от температуры. Внутренняя энергия является функцией состояния, т.е. определяется только состоянием системы (в данном случае – температурой) и не зависит от вида перехода в это состояние. Если система совершает круговой процесс (цикл), возвращаясь в начальное состояние, то полное изменение ее внутренней энергии равно нулю: Изменить внутреннюю энергию системы можно двумя способами: 1) совершить над ней механическую работу; 2) сообщить системе количество теплоты. (Напомним, что 1 кал = 4,19 Дж.) Первое начало термодинамики: количество теплоты, сообщенное системе, идет на приращение её внутренней энергии и на совершение системой работы над внешними телами: DQ = DU + DA или dQ = dU + dA. (40) Входящие в формулу (40) величины могут быть, как положительными, так и отрицательными. Если количество теплоты передается системе, она нагревается и сама совершает работу над внешними телами, то величины – положительны. Если количество теплоты отбирается от системы, она остывает, и внешние силы совершают над ней работу, то величины – отрицательны. Если система, например рабочее тело, в периодически действующем двигателе совершает круговой процесс (цикл), т.е. возвращается в исходное состояние, то DU = 0 и при этом DA = DQ. Отсюда следует вторая формулировка первого начала термодинамики: невозможен вечный двигатель 1-го рода, т.е. такое периодически действующее устройство, которое бы совершало работу в большем количестве, чем полученная им извне энергия.
На графике в координатах (p, V) работа равна площади фигуры, ограниченной осью V, прямыми V1 и V2 и кривой p = f (V). Из рис. 23 видно, что работа (площадь под кривой) зависит от вида перехода системы из состояния 1 в состояние 2. Кроме того, работа в круговом процессе может быть не равна нулю. Поэтому работа А не является функцией состояния, а ее элементарное изменение не является полным дифференциалом. Для элементарной работы употребляют обозначения dА или d¢A (а не дифференциал dA). Если внешние силы уменьшают объем газа (рис. 24), то при интегрировании получается "отрицательная" работа, так как верхний предел интегрирования V2 меньше нижнего V1. Применим первое начало термодинамики к изопроцессам.
Выражение (42) определяет физический смысл газовой постоянной: если n = 1 моль и Т2 – Т1 = 1 К, то А = R, т. е. R численно равна работе изобарного расширения 1 моля идеального газа при нагревании его на 1 К.
идеального газа
Средняя энергия 1 молекулы равна где i – число степеней свободы молекулы. Внутренняя энергия 1 моля идеального газа, содержащего число Авогадро молекул, равна Для n молей газа внутренняя энергия равна Теплоемкостью тела называется количество теплоты, которое нужно подвести к телу, чтобы повысить его температуру на один градус (например, теплоемкость калориметра): СТЕЛА Теплоемкость 1 моля называют молярной теплоемкостью С (или С m) [Дж/(моль×К)]. При этом Q = Cm n (T2 – T1). (45) Теплоемкость единицы массы вещества называют удельной теплоемкостью с [Дж/(кг×К)]. При этом Q = c m (T2 – T1). (46) Молярная и удельная теплоемкости связаны через молярную массу:
Пусть нагревание 1 моля идеального газа происходит при V = const. Тогда из первого начала термодинамики следует
Из уравнения (48) также можно получить важное соотношение: Пусть нагревание 1 моля идеального газа происходит при p = const. Тогда молярная теплоемкость при постоянном давлении равна
Разделим уравнение (40) первого начала термодинамики на dT:
Для нахождения производной dV/dT выразим объем из уравнения Клапейрона-Менделеева для 1 моля: V = RT/p. Таким образом,
Мы получили уравнение Майера: Кроме того, выражение dA/dT = R определяет физический смысл газовой постоянной R: газовая постоянная численно равна работе, которая совершается при расширении 1 моля идеального газа, нагретого на 1 градус при постоянном давлении [Дж/(моль К)]. Молярная теплоемкость при постоянном давлении может быть выражена из уравнения Майера (49): Отношение теплоемкостей представляет собой характеристическую для каждого газа величину (показатель адиабаты). Для одноатомного газа (i = 3) g = 1,67. Для двухатомного газа (i = 5) g = 1,4. Для трехатомного газа (i = 6) g = 1,33. Полученные формулы для теплоемкости дают хорошее совпадение с экспериментом для одноатомных и многих двухатомных газов (H2, O2, N2) при комнатной температуре. Однако, существуют и различия эксперимента и теории, которые объясняются квантовой теорией теплоемкости.
11. Адиабатический процесс
Адиабатический процесс – это процесс, протекающий без теплообмена с внешней средой. Тогда из первого начала термодинамики следует: dQ = 0 Þ dU + dA = 0 Þ Таким образом, при адиабатическом расширении газ совершает работу за счет убыли его внутренней энергии. Это обозначает, что его температура понижается (а если газ адиабатически сжимать, то он нагревается). Поэтому при адиабатическом процессе изменяются все три параметра – p, V, T. Следовательно, он не может называться изопроцессом. Найдем уравнение адиабаты для произвольного числа молей n. Для чего используем первое начало термодинамики: dA + dU = 0; p dV + n CV dT = 0. (53) Исключим из уравнения (53) температуру, продифференцировав уравнение Клапейрона-Менделеева: pV = n RT Þ p dV + V dp = n R dT Þ
Подставим формулу (54) в уравнение (53), приведем выражение к общему знаменателю и учтем то, что дробь равна нулю, если ее числитель равен нулю (число молей n при этом сокращается):
p CP dV – p CV dV + p CV dV + V CV dp = 0 (делим на pVCV),
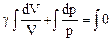
g ln V + ln p = ln (const)
Уравнение (55) является уравнением Пуассона (адиабаты), а величина Изобразим изотерму и адиабату на одном графике. Для этого продифференцируем их уравнения: T = const, pV = const, p dV + V dp = 0 Þ Q = const, pVg = const,
Следовательно, тангенс угла наклона (производная) адиабаты в g раз больше, чем у изотермы: адиабата идет круче, поскольку при расширении газа давление уменьшается не только за счет увеличения объема, но и за счет уменьшения температуры самой системы (рис. 28). Можно найти и другие формы записи уравнения адиабаты, подставив в уравнение (55) давление или объем, найденные из уравнения Клапейрона-Менделеева (pV = RT):
Возведем последнее уравнение в степень (1/g): Изотермический и адиабатический процессы являются идеализированными: изотермический требует идеального теплового контакта с окружающей средой, а адиабатический – идеальной теплоизоляции. Близкими к адиабатическому являются быстропротекающие процессы, когда теплообменом можно пренебречь. Найдем работу при адиабатическом изменении объема газа. Пусть при этом р1 – начальное давление газа, а V1 – его начальный объем.
Если по условию задачи даны температуры, то в уравнении (58) можно произвести замены p1V1 = (m/M) RT1 и
Из уравнения (52) можно получить и другую формулу для работы n молей газа:
12. Политропический процесс
Политропическими называются процессы, при которых теплоемкость тела остается постоянной (C = const). Изобарический, изохорический, изотермический и адиабатический процессы являются частными случаями политропического процесса. В самом деле: при изохорическом процессе (V = const) при изобарическом процессе (p = const) при адиабатическом процессе при изотермическом процессе (при изотермическом процессе сообщение телу любого количества теплоты не приводит к изменению температуры тела). Найдем уравнение политропы. Для простоты проведем расчет для 1 моля газа (если проводить расчет для произвольного числа молей, то число молей n при этом сокращается). Воспользуемся определением теплоемкости: Из первого начала термодинамики следует: dQ = dU + dA, C dT = CV dT + p dV, (C – CV) dT – p dV = 0. (61) Аналогично тому, как это делалось при выводе уравнения адиабаты, исключим из уравнения (61) температуру: pV = RT Þ p dV + V dp = R dT Þ
Подставим формулу (62) в уравнение (61), приведем выражение к общему знаменателю и учтем то, что дробь равна нулю, если ее числитель равен нулю:
C p dV + CV dp – CV p dV – CV V dp – CP p dV + CV p dV = 0, (C – CP) p dV + (C – CV) V dp = 0 [делим на (C – CV) pV],
Введем показатель политропы как
Продолжаем решать уравнение (63):
n ln V + ln p = ln (const),
Уравнение (65) является уравнением политропы в координатах (p,V). Уравнение политропы в других координатах можно получить аналогично тому, как это делалось для уравнения адиабаты (или проще: индекс g в уравнениях адиабаты можно заменить на n). В рассмотренных уравнениях переменная С – это теплоемкость газа в конкретном процессе (в общем виде – политропическом). Получим из общего уравнения (65) его частные случаи (процессы): адиабатический С = СА = 0 ® (64) Þ pVg = const; изотермический С = СТ = ¥ ® (64) Þ pV = const; изобарический С = СР ® (64) Þ pV0 = p ×1 = p = const; изохорический С = СV ® (64) Þ Из уравнения (65) извлечем корень n-й степени и получим
При подстановке в последнее уравнение величины n = ¥ имеем p0V = 1×V = V = const. 13. Энтропия. Второе и третье начала термодинамики
Система находится в термодинамическом равновесии, если макроскопические величины, определяющие ее состояние (p, V, T), остаются постоянными (нет процессов теплопроводности, диффузии, химических реакций, фазовых переходов и т.п.). Будучи выведенной из состояния равновесия внешними воздействиями система самопроизвольно возвращается к термодинамическому равновесию. При обратимых процессах система возвращается в исходное состояние так, что как в самой системе, так и в окружающей среде не остается никаких изменений. Обратимым является процесс, для которого возможен обратный переход из конечного состояния в начальное через те же промежуточные состояния, что и в прямом процессе. Обратимыми являются все движения, рассматриваемые в механике, кроме тех, в которых участвуют диссипативные силы. В молекулярной физике большинство процессов необратимо и имеет односторонний характер (переход тепла от горячего тела к холодному, распространение газа на весь объем, смешивание двух различных газов при диффузии). Возьмем уравнение первого начала термодинамики: dQ = dU + dA = nCV dT + p dV. (66) Найдем из уравнения Клапейрона-Менделеева давление p = nRT/V и подставим его в уравнение (66):
Правая часть равенства (67) представляет собой полный дифференциал, следовательно, и левая часть также является полным дифференциалом. Функция состояния, полный дифференциал которой равен dQ/T, называется энтропией и обозначается буквой S: Свойства энтропии: Энтропия замкнутой системы, совершающей обратимый цикл, не изменяется dSОБР = 0, или S = const. В ходе необратимого процесса энтропия замкнутой системы возрастает dSНЕОБР > 0 и достигает максимального значения в равновесном состоянии (т.е. S2 > S1). Второе начало термодинамики: энтропия замкнутой системы при любых происходящих в ней процессах не убывает dS ³ 0. (Знак (>) соответствует необратимому процессу, а знак (=) - обратимому.) Если же система не замкнута, т.е. может обмениваться теплотой с окружающей средой, то энтропия может вести себя любым образом (увеличиваться, уменьшаться, не изменяться). Энтропию можно также определить статистически с помощью формулы Больцмана: S = k ln W, где k – постоянная Больцмана, W – число различных равновероятных микросостояний (всевозможных распределений частиц по координатам и скоростям), которые реализуют данное термодинамическое макросостояние (p, V, T). W – число способов, реализуя которые система может прийти к данному равновесному состоянию. В равновесном состоянии макропараметры (p, V, T) постоянны, однако микропараметры (скорости, координаты, импульсы частиц) постоянно меняются. Поэтому число W очень огромно. Состояние, которое осуществляется многими способами, называется беспорядочным или случайным. Следовательно, энтропия является мерой беспорядка в системе. Сообщение системе количества теплоты приводит к усилению хаотического движения молекул, увеличивает (энтропию) степень беспорядка в системе. При абсолютном нуле Т = 0, движения нет, и все атомы тела закреплены в определенных местах. Существует только одно микросостояние W = 1. Следовательно, энтропия равна нулю: S = k ln 1 = 0. Отсюда следует третье начало термодинамики (теорема Нернста): энтропия любого тела стремится к нулю при стремлении температуры к нулю или при Т = 0 в любом процессе DS = 0. Всякий естественный процесс всегда протекает так, что система переходит в состояние с более высокой степенью беспорядка, так как такое состояние характеризуется большей термодинамической вероятностью. С этим связана и необратимость тепловых процессов: беспорядок в системе увеличивается. Любой вид энергии (механической, электрической и т.п.) в конечном итоге переходит в тепловые (хаотические) колебания атомов и молекул. Энтропия биологической системы "организм – внешняя среда" возрастает, а энтропия организма сохраняется (в небольшом интервале времени – биологическая стационарность). Упорядоченность организма сохраняется за счет уменьшения упорядоченности окружающей среды.
Из определения энтропии следует, что площадь под кривой на диаграмме (T, S) численно равна количеству теплоты Q12, полученному телом в ходе процесса 1 ® 2 (рис. 29): dQ = T dS, Для изотермического процесса Q12 = T (S2 – S1). Как видно из рис. 29, количество теплоты (площадь под кривой) зависит от вида перехода 1 ® 2. Следовательно, количество теплоты Q не является функцией состояния, а ее элементарное изменение dQ не является полным дифференциалом. 14. Расчет изменения энтропии в процессах идеального газа, при нагревании и плавлении
Расчет изменения энтропии в процессах идеального газа производится по формуле dS = d (nCV ln T + nR ln V). (70) Изотермический процесс. Так как T = const, то формула (70) упро-щается (первое слагаемое при дифференцировании обратится в нуль): dS = nR d (ln V). Интегрируем:
Из формулы (71) видно, что энтропия возрастает при увеличении объема газа. Из закона Бойля-Мариотта p1V1 = p2V2 можно произвести замену V2/V1 = p1/p2. Таким образом, получаются формула
Изохорический процесс. Так как V = const, то формула (70) упроща-ется (второе слагаемое при дифференцировании обратится в нуль): Изменение энтропии можно найти и другим способом, используя определение молярной теплоемкости:
Изобарический процесс. Для вычисления DS по формуле (70) необ-ходимо выразить температуру Т или объем V из уравнения Клапейрона-Менделеева, например, подставим объем V = nRT/p в формулу (70):
При другом способе вычисления DS применяют определение молярной теплоемкости (и используют замену T2/T1 = V2/V1 при р = const):
Адиабатический процесс. Энтропия обладает аддитивностью: энтропия системы равна сумме энтропий тел, входящих в систему. Для нахождения DS в газовых процессах выбираются любые удобные для расчетов процессы. Изменение энтропии при нагревании тел. Q = cm (t2 – t1), dQ = cm dT; где с – удельная теплоемкость. Изменение энтропии при плавлении. Q = lm, dQ = l dm, Интегрирование ведется от 0 до m, так как идет процесс появления новой фазы вещества. Температура плавления ТПЛ и удельная теплота плавления l – величины постоянные. Аналогичной формулой выражается изменение энтропии при парообразовании. Только в формулу (76) подставляются температура кипения ТПАР и удельная теплота парообразования r. Если вещество нагревалось, плавилось, нагревалось, испарялось и т.д., то общее изменение энтропии будет равно сумме изменений энтропии в отдельных процессах:
15. Цикл Карно. Второе начало термодинамики
Теплота и работа, как две формы передачи энергии неравноценны. Если механическая работа всегда может самопроизвольно перейти в тепловую энергию, то обратный процесс возможен лишь в тепловых машинах (двигателях). Круговым процессом, или циклом, называется такая совокупность термодинамических процессов, в результате которых система возвращается в исходное состояние. Все преобразователи энергии (двигатели) работают циклически, т.е. процессы преобразования тепла в работу периодически повторяются. Тепловой машиной называется периодически действующее устройство, совершающее работу за счет получаемого извне количества теплоты. Тепловая машина состоит из нагревателя, рабочего тела (газ) и холо
дильника (рис. 30). Пусть рабочее тело (газ), получив от нагревателя количество теплоты Q1, расширяясь от V1 до V2, совершает работу (поднимает поршень). Для того, чтобы вернуться в начальное состояние, надо газ сжать. Чтобы работа за цикл была больше нуля, необходимо сжатие осуществлять при более низком давлении и температуре, т.е. передать часть тепла Q2 холодильнику. Обычно холодильником служит атмосфера. Поскольку за цикл изменение внутренней энергии равно нулю, то из первого начала термодинамики следует, что работа равна A = Q1 – Q2. Для характеристики эффективности тепловой машины вводят коэффициент полезного действия (КПД) как отношение совершенной за цикл работы к полученному количеству теплоты Циклом с максимальным КПД, в котором отсутствуют бесполезные потери тепла, является цикл Карно, состоящий из двух изотерм и двух адиабат. Рассмотрим цикл Карно на диаграмме (p, V), изображенный на рис. 31.
Процесс 2-3. В точке 2 рабочее тело отключают от нагревателя и заключают в адиабатическую оболочку. Дальнейшее расширение идет в адиабатическом режиме: DQ = 0, A2 = -DU = CV (T1 - T2). (Невыгодно просто охладить газ, соединив его с холодильником. Газ, адиабатически расширяясь, продолжает совершать работу.) Процесс 3-4. Газ, соединив с холодильником, сжимают изотермически, чтобы не повышать его внутреннюю энергию: Т2 = const, DU = 0, Процесс 4-1. Газ сжимают адиабатно, чтобы он нагрелся до температуры нагревателя: DQ = 0, A4 = – DU = CV (T2 – T1). КПД равен Можно показать, что V2/V1 = V3/V4. Для этого запишем уравнения адиабаты для процессов 2-3 и 1-4 и поделим одно уравнение на другое:
При выводе формулы КПД мы не делали никаких предположений о свойствах рабочего тела и устройстве тепловой машины. Следовательно, мы пришли к теоремам Карно: 1. КПД цикла Карно не зависит от рода рабочего тела и определяется только температурами нагревателя и холодильника. 2. КПД любой необратимой машины (реальной) всегда меньше, чем КПД обратимой машины (Карно), работающей в тех же условиях (Т1, Т2). Существуют различные формулировки 2-го начала термодинамики. Формулировка Кельвина: Невозможен вечный двигатель второго рода, т.е. такой периодически действующий двигатель, который бы полностью превращал в работу количество теплоты, взятое от теплового резервуара (т.е. работал бы только за счет охлаждения одного источника теплоты Q1 = A). Формулировка Клаузиуса: невозможен циклический процесс, единственным результатом которого была бы передача теплоты от менее нагретого тела к более нагретому (т.е. теплота не может самопроизвольно переходить от тела менее нагретого к более нагретому).
коэффициентом, который определяется как отношение отнятой от охлаждаемого тела теплоты Q2 к работе А, которая затрачивается на приведение машины в действие:
Следовательно, без совершения работы нельзя отбирать теплоту от менее нагретого тела и отдавать ее более нагретому (см. формулировку Клаузиуса). Если подсчитать КПД цикла Карно для Т1 = 100 °С и Т2 = 0 °С, то получится около 27%. Для увеличения КПД обычно увеличивают температуру нагревателя.
Примечание: формула КПД для простоты выводилась для 1 моля (из расчетов видно, что при произвольном числе молей величина n сокращается). Предельно просто выглядит цикл Карно на диаграмме (T, S). Количества теплоты Q1 и Q2 на рис. 33 – это площади двух прямоугольников (см. рис. 29):
16. Реальные газы. Критическое состояние
Реальные газы (H2, O2, N2) подчиняются законам идеальных газов, когда они имеют малую плотность (это выполняется при комнатных температурах и атмосферном давлении). При увеличении давления и снижении температуры наблюдаются значительные отклонения от уравнения pV = nRT, поскольку при увеличении плотности начинают играть все большую роль собственный объем молекул и силы притяжения между ними. Реальные газы обладают такими свойствами, которые не могут быть получены из уравнений для идеальных газов.
Семейство реальных изотерм показано на рис. 36. Существует такая критическая изотерма, для которой горизонтальные участки стягиваются в критическую точку К. Критическая точка определяется критической температурой ТК, критическим давлением рК, и удельным (молярным) критическим объемом VК. Зависимость плотности r жидкости и насыщенного пара показана на рис. 37. При критической температуре исчезают различия в плотностях жидкости и насыщенного пара, и вещество становится однородным. Обращаются в нуль удельная теплота парообразования и коэффициент поверхностного натяжения (так как исчезает сама поверхность жидкости).
Если в справочнике посмотреть критические температуры различных газов [водород (– 240 °С), азот (– 147 °С), кислород (– 119 °С), углекислый газ (+ 31 °С), вода (+ 374 °С)], то понятно, почему газы, составляющие воздух, при комнатных температурах являются "идеальными", а для опыта, изображенного на рис. 34, выбран углекислый газ. 17. Уравнение Ван-дер-Ваальса
Из множества различных уравнений, предложенных для реального газа, наиболее простым и точным является уравнение Ван-дер-Ваальса (В-д-В). В модели реального газа В-д-В молекулы рассматриваются как абсолютно твердые шарики с эффективным диаметром d, между которыми действуют силы взаимного притяжения и отталкивания. Уравнение В-д-В является приближенным, так как не существует точного способа вычисления сил взаимодействия между молекулами. Уравнение В-д-В сводится к поправкам к уравнению идеального газа и для 1 моля имеет вид (уравнение состояния реальных газов)
Поправка
|

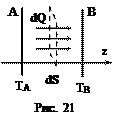 Закон Фурье: количество теплоты dQ, которое переносится при теплопроводности за время dt через площадку dS, расположенную перпендикулярно оси z равно
Закон Фурье: количество теплоты dQ, которое переносится при теплопроводности за время dt через площадку dS, расположенную перпендикулярно оси z равно , (37)
, (37) , (38)
, (38)
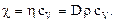 (39)
(39)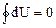 . Как известно, математически это соотношение означает, что элементарное изменение dU является полным (точным) дифференциалом.
. Как известно, математически это соотношение означает, что элементарное изменение dU является полным (точным) дифференциалом. Найдем работу, которую совершает газ при расширении. Пусть газ, действуя на поршень с силой F = pS, перемещает его на расстояние dx (рис. 22) и совершает элементарную работу dA = F dx = pS dx = p dV.
Найдем работу, которую совершает газ при расширении. Пусть газ, действуя на поршень с силой F = pS, перемещает его на расстояние dx (рис. 22) и совершает элементарную работу dA = F dx = pS dx = p dV.
 . (41)
. (41) Изохорический процесс V = const (рис. 25). Так как V = const, то dV = 0 и DА = 0. Из уравнения первого начала термодинамики остается DQ = DU. В изохорическом процессе все количество теплоты, подводимое к системе, полностью идет на изменение ее внутренней энергии.
Изохорический процесс V = const (рис. 25). Так как V = const, то dV = 0 и DА = 0. Из уравнения первого начала термодинамики остается DQ = DU. В изохорическом процессе все количество теплоты, подводимое к системе, полностью идет на изменение ее внутренней энергии. Изобарический процесс р = const (рис. 26). В этом процессе изменяется внутренняя энергия и совершается работа dQ = dU + pdV. Работа в данном случае вычисляется очень просто (это площадь прямоугольника):
Изобарический процесс р = const (рис. 26). В этом процессе изменяется внутренняя энергия и совершается работа dQ = dU + pdV. Работа в данном случае вычисляется очень просто (это площадь прямоугольника):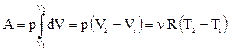 . (42)
. (42)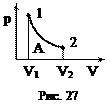 Изотермический процесс T = const (рис. 27). При этом процессе dU = 0, следовательно, dQ = dA, т.е. всё подводимое количество теплоты тратится на совершение работы над внешними телами. Для нахождения работы выразим зависимость p = f (V) из уравнения Клапейрона-Менделеева: p = nRT/V. Работа равна
Изотермический процесс T = const (рис. 27). При этом процессе dU = 0, следовательно, dQ = dA, т.е. всё подводимое количество теплоты тратится на совершение работы над внешними телами. Для нахождения работы выразим зависимость p = f (V) из уравнения Клапейрона-Менделеева: p = nRT/V. Работа равна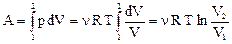 . (43)
. (43) ,
,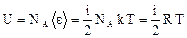 .
. .
. [Дж/К]. (44)
[Дж/К]. (44) (47) (или Cm v = M cv, Cm p = M cp, где cV и cP см. далее).
(47) (или Cm v = M cv, Cm p = M cp, где cV и cP см. далее). и
и 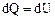 , и молярная теплоемкость при постоянном объеме равна
, и молярная теплоемкость при постоянном объеме равна
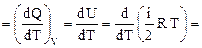
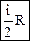 . (48)
. (48) , а внутренняя энергия n молей равна
, а внутренняя энергия n молей равна  .
. .
.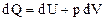 ,
, 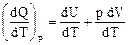 ,
,  .
.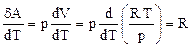 .
. . (49)
. (49)
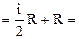
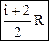 . (50)
. (50) (51)
(51) . (52)
. (52)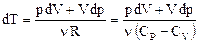 . (54)
. (54)
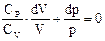 (интегрируем),
(интегрируем),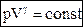 . (55)
. (55)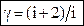 > 1 является показателем адиабаты.
> 1 является показателем адиабаты. .
. Þ
Þ  .
.
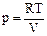 ® (55) Þ
® (55) Þ  ,
, 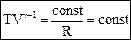 . (56)
. (56) ® (55) Þ
® (55) Þ  ,
,  .
.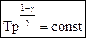 . (57)
. (57) Þ
Þ 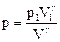 .
.
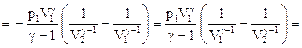
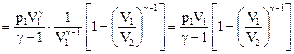 . (58)
. (58)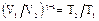
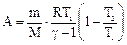 . (59)
. (59) . (60)
. (60) ;
;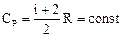 ;
;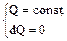
 ;
;

 .
. . (62)
. (62)
 (63)
(63) . (64)
. (64)
 . (65)
. (65) ® (65)
® (65)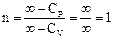 ® (65)
® (65)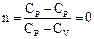 ® (65)
® (65) .
.
 . Разделим обе части уравнения на Т:
. Разделим обе части уравнения на Т: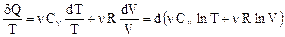 . (67)
. (67) . (68)
. (68) Второе начало термодинамики, установленное для замкнутых систем на Земле не может быть распространено на всю бесконечную Вселенную. Иначе можно прийти к выводу, что температуры всех тел во Вселенной станут одинаковыми. При этом все формы движения, кроме хаотического теплового, должны прекратиться. Наступит "тепловая смерть Вселенной";.
Второе начало термодинамики, установленное для замкнутых систем на Земле не может быть распространено на всю бесконечную Вселенную. Иначе можно прийти к выводу, что температуры всех тел во Вселенной станут одинаковыми. При этом все формы движения, кроме хаотического теплового, должны прекратиться. Наступит "тепловая смерть Вселенной";. . (69)
. (69)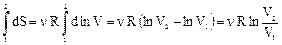 . (71)
. (71) . (72)
. (72)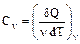 Þ dQ = n CV dT;
Þ dQ = n CV dT;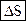

 . (73)
. (73)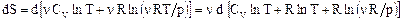 ,
,
 ,
, .
. Þ dQ = n CP dT;
Þ dQ = n CP dT;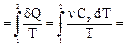
 . (74)
. (74) , так как DQ = 0 (энтропия не изменяется). При адиабатном расширении газа энтропия возрастает за счет увеличения объема, но и уменьшается за счет понижения температуры, и эти два процесса полностью компенсируют друг друга.
, так как DQ = 0 (энтропия не изменяется). При адиабатном расширении газа энтропия возрастает за счет увеличения объема, но и уменьшается за счет понижения температуры, и эти два процесса полностью компенсируют друг друга. ;
; 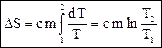 ; (75)
; (75) . (76)
. (76)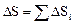 .
.
 . (77)
. (77)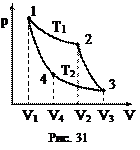 Процесс 1-2. Газ получает от нагревателя (с температурой Т1) количество теплоты Q1 и расширяется. Наилучшим процессом является изотермическое расширение, так как DU = 0 и все количество теплоты идет на совершение работы
Процесс 1-2. Газ получает от нагревателя (с температурой Т1) количество теплоты Q1 и расширяется. Наилучшим процессом является изотермическое расширение, так как DU = 0 и все количество теплоты идет на совершение работы  .
. .
.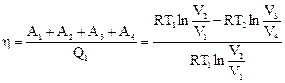 .
. . Следовательно,
. Следовательно, 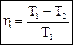 . (78)
. (78)
 Если провести цикл, изображенный на рис. 31, в обратном направлении, то получится цикл холодильной машины. На приведение машины в действие затрачивается работа А (рис. 32). При этом машина отбирает за цикл от тела с температурой Т2 количество теплоты Q2 и отдает телу с более высокой температурой Т1 количество теплоты Q1 = Q2 + A. Эффективность холодильной машины характеризуется ее холодильным
Если провести цикл, изображенный на рис. 31, в обратном направлении, то получится цикл холодильной машины. На приведение машины в действие затрачивается работа А (рис. 32). При этом машина отбирает за цикл от тела с температурой Т2 количество теплоты Q2 и отдает телу с более высокой температурой Т1 количество теплоты Q1 = Q2 + A. Эффективность холодильной машины характеризуется ее холодильным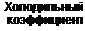
 . (79)
. (79) Примеры КПД: паровоз – 9%, карбюраторный двигатель – 25–30%, дизель – 30–40%, паровая турбина (пар 500 °С) – 30–40%.
Примеры КПД: паровоз – 9%, карбюраторный двигатель – 25–30%, дизель – 30–40%, паровая турбина (пар 500 °С) – 30–40%.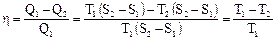 .
. Пусть в прозрачном цилиндре с поршнем, манометром и термометром (рис. 34) имеется углекислый газ. Начнем сжимать газ изотермически при комнатной температуре. При некотором давлении газ начнет конденсироваться. При этом в объеме существуют две фазы - жидкая и газообразная. Пока идет конденсация, давление остается постоянным, а объем газа уменьшается за счет перехода газа в жидкость. Поршень опускается до тех пор, пока полностью не ляжет на жидкость. Затем давление резко возрастает, и изотерма круто идет вверх, так как сжимаемость жидкости мала. Изотерма реального газа показана на рис. 35.
Пусть в прозрачном цилиндре с поршнем, манометром и термометром (рис. 34) имеется углекислый газ. Начнем сжимать газ изотермически при комнатной температуре. При некотором давлении газ начнет конденсироваться. При этом в объеме существуют две фазы - жидкая и газообразная. Пока идет конденсация, давление остается постоянным, а объем газа уменьшается за счет перехода газа в жидкость. Поршень опускается до тех пор, пока полностью не ляжет на жидкость. Затем давление резко возрастает, и изотерма круто идет вверх, так как сжимаемость жидкости мала. Изотерма реального газа показана на рис. 35.

 Колоколообразная кривая, соединяющая крайние точки горизонтальных участков изотерм, и критическая изотерма делят диаграмму (p, V) на четыре области (рис. 38). При температуре выше критической образование жидкости уже ни при каких давлениях невозможно. В этой области справедливы уравнения идеального газа (или вблизи критической изотермы – уравнения реального газа). Чтобы газ сконденсировать, его нужно охладить ниже критической температуры. Поэтому ниже критической изотермы располагаются область жидкого состояния, область двухфазных состояний (жидкость и насыщенный пар) и область пара. Термин "пар" обычно применяют к газу, который при изотермическом сжатии можно сконденсировать.
Колоколообразная кривая, соединяющая крайние точки горизонтальных участков изотерм, и критическая изотерма делят диаграмму (p, V) на четыре области (рис. 38). При температуре выше критической образование жидкости уже ни при каких давлениях невозможно. В этой области справедливы уравнения идеального газа (или вблизи критической изотермы – уравнения реального газа). Чтобы газ сконденсировать, его нужно охладить ниже критической температуры. Поэтому ниже критической изотермы располагаются область жидкого состояния, область двухфазных состояний (жидкость и насыщенный пар) и область пара. Термин "пар" обычно применяют к газу, который при изотермическом сжатии можно сконденсировать.
 , (80)
, (80)


