Капиллярные явления
Можно взять такой узкий сосуд (трубка или узкая щель), что искривленной оказывается вся поверхность жидкости (плоской поверхности нет). Если расстояние между стенками сосуда сравнимо с радиусом кривизны поверхности жидкости, то такие сосуды называются капиллярами, а происходящие в них явления – капиллярными явлениями.
Если Q - краевой угол жидкости, то из рис. 58 следует, что радиус кривизны мениска равен
Силы давления Dр направлено к центру кривизны, т.е. вверх, и жидкость поднимается до высоты h, на которой давление Лапласа уравновешивает гидростатическое давление:
Для полного смачивания (Q = 0, cos Q = 1) получаем:
Если жидкость не смачивает капилляр (рис. 59), мениск будет выпуклый, центр кривизны находится внутри жидкости, силы давления Лапласа направлены вниз. Глубину опускания жидкости ("отрицательную высоту") находят по тем же формулам. Знак "минус" перед высотой h появляется автоматически, так как косинус тупого угла – отрицателен. Для полного несмачивания Q = p. Если рассматривать рис. 58 как вид поверхности жидкости между двумя параллельными пластинками, то путем аналогичных рассуждений можно получить формулу для расчета высоты поднятия жидкости между ними: 22. Фаза. Фазовое равновесие. Общая характеристика фазовых переходов 1-го и 2-го рода
Фазой называется термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества. Если различные фазы вещества при данных давлении и температуре существуют одновременно, соприкасаясь друг с другом, и если при этом масса одной из фаз не растет за счет другой, то говорят о фазовом равновесии. Переход из одного состояния (фазы) в другое называется фазовым переходом. При этом скачкообразно изменяются физические свойства вещества. Часто понятие "фаза" употребляют в смысле агрегатного состояния, однако надо учитывать, что это два разных понятия. В пределах одного агрегатного состояния вещество может находиться в нескольких фазах, отличающихся по своим свойствам и строению. Например, лед встречается в пяти различных модификациях – фазах, а жидкий гелий может быть "обычным" и "сверхтекучим". Фазовые переходы с выделением или поглощением скрытой теплоты перехода называются фазовыми переходами первого рода. К ним относятся плавление, парообразование, сублимация (переход твердого тела в газообразное состояние), конденсация и кристаллизация. Скрытая теплота перехода затрачивается на преодоление сил притяжение между молекулами. Теплота называется "скрытой" потому, что теплота (например, при плавлении и кипении) к телу подводится, а температура тела при этом не повышается. Фазовые переходы первого рода характеризуются изменениями энтропии и удельного объема. При фазовых переходах первого рода новая фаза не возникает сразу во всем объеме. Сначала образуются зародыши новой фазы, которые затем растут, распространяясь на весь объем. Зародыши (центры парообразования, конденсации, кристаллизации…) появляются на различных неоднородностях (пылинки, ионы, шероховатости стенок сосуда). В отсутствии таких центров вещества могут находиться в перегретом или переохлажденном состоянии. Например, чистая вода не замерзает при минус 10 °С. Твердое состояние вещества может реализовываться в различных кристаллических модификациях. Это явление называется полиморфизмом. Например: графит и алмаз (углерод); белое и серое олово; белый и красный фосфор; существует несколько разновидностей льда (например, при давлении 20 000 атм лед плавится при +75 °С) и т.п. Фазовые переходы из одной кристаллической модификации в другую, не связанные с выделением или поглощением тепла, называются фазовыми переходами второго рода. При определенной температуре изменение физических свойств происходит сразу во всем объеме. Фазовые переходы второго рода всегда связаны с изменением симметрии системы: либо изменяется уже существующий порядок (кристаллической решетки), либо в новой фазе возникает порядок, которого не было в первоначальной (например, упорядочиваются магнитные моменты отдельных частиц при переходе в ферромагнитное состояние). Примеры фазовых переходов второго рода: - превращение железа в точке Кюри (770 °С) из ферромагнитного в парамагнитное состояние; - переход металлов в сверхпроводящее состояние; - переход жидкого гелия при температуре ниже 4,2 К в сверхтекучее состояние (с вязкостью близкой к нулю).
23. Уравнение Клапейрона - Клаузиуса. Тройная точка. Фазовые диаграммы состояний
Рассмотрим фазовые переходы первого рода. Процесс парообразования, происходящий со свободной поверхности жидкости, называется испарением. Испарение происходит при любой температуре и возрастает при ее повышении. Очевидно, что не все молекулы способны преодолеть силы поверхностного натяжения, а лишь "наиболее быстрые", обладающие достаточной кинетической энергией. Поэтому жидкость при испарении охлаждается. Ощущение сильного охлаждения кожи, смоченной летучей (быстро испаряющейся) жидкостью (эфир, спирт), объясняется этим эффектом. Количество теплоты, которое необходимо подвести к определенному количеству жидкости (кг, моль), чтобы испарить ее изотермически, при внешнем давлении, равном упругости ее насыщенных паров, называется скрытой теплотой испарения (парообразования). Это количество теплоты уменьшается при увеличении температуры и становится равным нулю при критической температуре (так как исчезают различия между жидкостью и её паром).
где L – удельная (молярная) скрытая теплота парообразования, V1, V2 – удельные (молярные) объемы веществ в исходной (жидкость) и конечной (пар) фазах, р и Т – давление и температура фазового перехода. Кипением называется интенсивное испарение жидкости не только со свободной поверхности, но и во всем объеме жидкости внутрь образующихся при этом пузырьков пара. Кипение начинается при такой температуре, при которой давление насыщенного пара внутри пузырька рН не меньше суммы трех давлений: внешнего (атмосферного), гидростатического и давления Лапласа Таким образом, температура кипения жидкости зависит от внешнего давления. Например, вода при 40 атм кипит при 250 °С, а на высоте Эвереста (h = 8848 м, р = 234 мм рт. ст.) – при 70 °С. Вода, нормально кипящая при 100 °С (при 1 атм), может кипеть и при комнатной температуре, если блюдце с водой поставить под колпак воздушного насоса и понизить внешнее давление. Тепло, необходимое для превращения жидкости в пар, заимствуется у самой жидкости, она охлаждается и может даже замерзнуть, интенсивно испаряясь с большой поверхности блюдца. Если жидкость однородна и в ней нет центров парообразования, то можно получить перегретую жидкость, нагрев ее выше температуры кипения. Поскольку объем пара больше объема такой же массы жидкости, то разность объемов (VП – VЖ) всегда больше нуля. Величины T и L в уравнении Клапейрона-Клаузиуса (88) также положительны. Значит, производная dp/dT (тангенс угла наклона кривой) положительна, а, следовательно, при увеличении давления температура кипения возрастает.
Температура плавления зависит от внешнего давления. При нагревании твердое тело расширяется, увеличиваются средние расстояния между частицами. Если препятствовать этому расширению внешним давлением, то вещество будет плавиться при более высокой температуре. Кривая плавления на диаграмме (рис. 62) соответствует следующему уравнению Клапейрона-Клаузиуса:
где LПЛ – удельная теплота плавления, VЖ, VТ – удельные объемы жидкой и твердой фаз; Т – температура плавления при давлении р. Если VЖ > VТ, то dp/dT > 0. Это значит, что при увеличении давления температура плавления возрастает (сплошная линия на рис. 62). Для некоторых веществ (лед, чугун, висмут, сурьма, германий) объем при плавлении уменьшается. Для них VЖ < VТ, производная dp/dT отрицательна, и на рис. 62 показан пунктиром другой наклон кривой плавления. Температура плавления для таких веществ уменьшается при увеличении давления. На диаграмме кривая плавления идет очень круто. Например, для того чтобы изменить температуру плавления льда на 1 градус, необходимо изменить давление на 132 атм.
Совместим все полученные зависимости на одном графике, который называется фазовой диаграммой состояний (рис. 64). В зависимости от объемов VЖ и VТ имеются разные кривые плавления.
Для воды в тройной точке ртр = 4,6 мм рт.ст. и tтр = 0,0075 °С, поэтому при атмосферном давлении при нагреве лед сначала плавится, а затем вода превращается в пар. Для углекислоты ртр = 5 атм, tтр = – 56,6 °С. Поэтому углекислота при атмосферном давлении может находиться только в твердом и газообразном состояниях. Фазовая диаграмма показывает, что кристаллическое вещество можно расплавить при нагревании лишь при условии р > ртр.
Тройных точек может быть несколько. Например, сера имеет три тройные точки, так как может существовать в двух кристаллических модификациях – моноклинной и ромбической, обозначенных на рис. 65 как "м" и "ромб.". При атмосферном давлении при нагреве ромбические кристаллы переходят в моноклинные, затем плавятся и закипают (см. пунктир на рис. 65).
24. Эффект Джоуля-Томсона
Эффект Джоуля-Томсона заключается в изменении температуры газа при его стационарном адиабатическом протекании через пористую перегородку.
В опытах Джоуля и Томсона (1852–1862) применялась теплоизолированная цилиндрическая трубка (рис. 66). В середине трубки между двумя металлическими сетками помещалась из плотной ваты или шелка пробка, которая представляла собой сопротивление для протекания газа – дроссель. (В технике вместо пористой перегородки используют узкие отверстия – сопла.) Было установлено что, если газ принудительно продавливать через пористое тело, то его температура изменяется. 1. Если газ при продавливании охлаждался DТ < 0 (Т2 < Т1), то это положительный эффект Джоуля-Томсона (наблюдается для большинства газов при комнатной температуре). 2. Если газ при продавливании нагревался DТ > 0 (Т2 > Т1) – это отрицательный эффект Джоуля-Томсона (наблюдается для водорода и гелия при комнатной температуре). 3. Возможен и нулевой эффект Джоуля-Томсона, когда температура газа не изменяется. Количественно эффект Джоуля-Томсона характеризуется дифференциальным коэффициентом Джоуля-Томсона m = DT/Dp, который, например для воздуха, составляет 0,25 град/атм. Если давление и объем газа меняются незначительно, то это дифференциальный эффект Джоуля-Томсона. В технике используют интегральный эффект Джоуля-Томсона (как большая сумма дифференциальных эффектов), при котором давление изменяется в широких пределах (до 100–200 атм).
DA = p2V2 - p1V1. (89) Так как система теплоизолирована, то из первого начала термодинамики следует, что DA = -DU = - (U2 - U1). (90) Подставив формулу (89) в уравнение (90), получим: p2V2 - p1V1 = U1 - U2 или p1V1 + U1 = p2V2 + U2. (91) Функция Энтальпия – это функция состояния, которая при изобарическом процессе играет такую же роль, какую при адиабатическом – внутренняя энергия U, а при изотермическом – свободная энергия F. Соотношение для энтальпии можно вывести из первого начала термодинамики: при p = const, dQ = dU + pdV = d (U + pV) = dH. Таким образом, приращение энтальпии при изобарическом процессе дает тепло, полученное системой. Для идеального газа энтальпия зависит только от температуры Для реального газа внутренняя энергия зависит и от объема, следовательно, температура, в общем случае, изменяется (Т1 ¹ Т2). Рассмотрим эффект Джоуля-Томсона в газе Ван-дер-Ваальса, используя график взаимной потенциальной энергии молекул (рис. 68).
В области I газ достаточно плотный и преобладают силы отталкивания. Поэтому в уравнении Ван-дер-Ваальса можно пренебречь силами притяжения (поправкой рВН = a / V2): p(V – b) = RT pV = RT + pb. (92) Из уравнения (91) найдем изменение внутренней энергии: DU = U2 – U1 = p1V1 – p2V2. (93) Воспользуемся уравнением (92): DU = RT1 + p1b – RT2 – p2b = R (T1 – T2) + b (p1 – p2). (94) Так как разность температур Т1 – Т2 обычно мала, то первым слагаемым в уравнении (94) можно пренебречь. Так как р1 – р2 > 0, то DU > 0 и внутренняя энергия возрастает. Следовательно, газ при дросселировании нагревается. В области II газ достаточно разряженный и преобладают силы притяжения молекул. Газ при расширении совершает работу по преодолению этих сил. В результате его внутренняя энергия, а следовательно, и температура должны уменьшаться. В самом деле, в области II в уравнении Ван-дер-Ваальса можно пренебречь поправкой на собственный объем молекул b:
Подставим уравнение (95) в уравнение (93):
Первым слагаемым в уравнении (96) можно пренебречь. Во втором слагаемом V2 > V1, поэтому DU < 0 и газ охлаждается. Рассмотрим общий случай. Мы имеем уравнение (91), т. е. H1 = H2 или p1V1 + U1 = p2V2 + U2. В состоянии 1 газ сильно сжат, и величины p1V1 и U1 следует находить из уравнения Ван-дер-Ваальса:
Считаем, что в состоянии 2 после расширения газ достаточно разряжен и можно пользоваться уравнениями идеальных газов для нахождения p2V2 и U2:
Подставляя формулы (97) и (98) в уравнение (91), можно выразить величину DТ:
Выражение (99) представляет собой общую формулу для изменения температуры газа при дросселировании. Для нулевого эффекта Джоуля-Томсона справедливо выражение DТ = 0, и уравнение (99) можно преобразовать к виду:
График функциональной зависимости (100) показан на рис. 69 и изображает кривую инверсии, при пересечении которой изменяется знак эффекта Джоуля-Томсона. Кривая инверсии при V1 ® ¥асимптотически стремится к значению Для примера приведем температуры инверсии для некоторых газов: гелий – 40 К, водород – 200 К, кислород – 1063 К, углекислый газ – 2073 К. Как видно из приведенных данных, водород при комнатных температурах при дросселировании всегда нагревается. Такое нагревание иногда приводило к катастрофам, в которых сильно сжатый водород самопроизвольно воспламенялся при истечении из поврежденных трубопроводов. Если сопоставить выражение для температуры инверсии Ti с критической температурой 25. Методы получения низких температур и сжижения газов
В технике применяют 3 основных метода для получения низких температур: 1) испарение жидкостей; 2) эффект Джоуля-Томсона; Газ может быть превращен в жидкое состояние только тогда, когда его температура ниже критической ТК. Сжижение газов, имеющих достаточно высокую ТК, обычно производят, сжимая газ компрессором, а затем охлаждают его до температуры ниже температуры кипения. Таким способом получают углекислоту (ТК = 304 К), хлор (ТК = 417 К), аммиак (ТК = 405 К). Для получения жидкого кислорода (ТК = 154 К), азота (ТК = 126 К), водорода (ТК = 33 К), гелия (ТК = 5 К) используют специальные установки.
Комната не может охладиться при открытой двери холодильника, так как тепло, взятое из морозильной камеры, выделяется на задней стенке холодильника (плюс потери тепла на нагрев электрической схемы). Поэтому надо обеспечить хорошую вентиляцию задней стенки холодильника, иначе мотор-компрессор перегреется и выйдет из строя. Первые машины для технического сжижения воздуха предложили независимо друг от друга в 1895 г. Хемпсон (Англия) и Линде (Германия) на эффекте Джоуля-Томсона. Упрощенная схема машины Линде показана на рис. 71. Во всех машинах для сжижения газов используется метод противоточного теплообмена. Давление при дросселировании падает с 200 до 1 атм с понижением температуры на 50 °С. Охлажденный воздух отводится к компрессору, по пути охлаждая новую порцию воздуха, идущего к дросселю. Через несколько циклов часть воздуха начинает конденсироваться. При адиабатическом расширении идеальные и реальные газы охлаждаются. Причиной охлаждения является то, что все молекулы, сталкивающиеся с движущимся поршнем, передают ему часть своей кинетической энергии и отражаются от него с меньшей, чем до удара, скоростью (рис. 72). Это приводит к уменьшению средней скорости молекул, а, следовательно, и к уменьшению температуры.
Более совершенным является турбодетандер П.Л.Капицы, в котором поршень заменен турбиной: газ, сжатый всего до 5–6 атм, вращает турбину и при этом, расширяясь до давления» 1,3 атм, сильно охлаждается. При прочих равных условиях эффект адиабатического охлаждения сильнее, чем при дросселировании. В промышленных установках для повышения эффективности комбинируют различные методы, разделяя газовые потоки, и используя предварительное охлаждение. Для получения сверхнизких температур (0,001 К) применяют метод магнитного охлаждения (адиабатического размагничивания). При этом используются парамагнитные соли (хромокалиевые или железоаммониевые квасцы), которые предварительно охлаждают до 0,7 К кипящим при пониженном давлении гелием. Затем соль намагничивают. Молекулы парамагнетика ориентируются в магнитном поле, возникает упорядоченность и энтропия уменьшается. Затем устраняют тепловой контакт гелия и парамагнетика (создавая тем самым условие адиабатичности) и выключают магнитное поле. Ионы ориентируются беспорядочно, что дает увеличение энтропии ионов. Но так как в адиабатическом процессе общая энтропия не должна изменяться, то должна уменьшиться энтропия, связанная с тепловыми колебаниями кристаллической решетки. Это приводит к уменьшению температуры. Сжиженные газы быстро испаряются. Для их сохранения применяются сосуды Дьюара или термосы. Это стеклянные или металлические сосуды с двойными (зеркальными) стенками, из которых выкачан воздух. Они обеспечивают почти адиабатическую оболочку. 26. Термодинамическая шкала температур. Термометры
Температура – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. При изменении температуры изменяются различные свойства вещества. Поэтому для создания термометра необходимо выбрать какое-либо термометрическое тело и определенную величину, характеризующую свойства вещества (термометрическую величину). Например, железный стержень и его длина. Необходимо установить единицу температуры – градус, и начало отчета шкалы температур. Современная термометрия основана на шкале идеального газа, устанавливаемой с помощью газового термометра постоянного объема. Газовый термометр является эталонным первичным термометром, по которому градуируют все вторичные термометры. При изохорном процессе (V = const) по закону Шарля p/T = const или pK/pO = TK/TO, где ТО и ТК – температуры таяния льда и кипения воды. Отношение pK/pO = 1,3661 легко определить из опыта. Размер градуса выбирается так: ТК – ТО = 100 (т.е. делением разности ТК – ТО на 100 частей). Из двух последних уравнений получают, что ТО = 273,15 К, ТК = 373,15 К. Но температуры ТО и ТК зависят от внешнего давления. Поэтому в системе СИ условились определять температуру по одной реперной (опорной) точке - тройной точке воды. Температура тройной точки воды принята равной 273,16 К. А единица температуры (кельвин) определяется как 1/273,16 температуры тройной точки воды. Выбрав газ в качестве термометрического тела, а его давление в качестве термометрической величины, можно определять температуру по формулам: Т = 273,16 × р / ртр.т или Т = 273,15 × р / р0, где ртр.т = 4,58 мм рт.ст – давление в тройной точке воды (tтр.т = 0,01 °С), р0 – давление при 0 °С (273,15 К), р – давление при измеряемой температуре. Определенная таким образом шкала температур называется термодинамической шкалой температур. (Существуют и другие температурные шкалы: Цельсия, Реомюра, Фаренгейта.)
Термин "термодинамическая температура" происходит от того, что можно совершенно независимо дать определение температуры из второго начала термодинамики и обратимого цикла Карно. В самом деле, если приравнять формулы, выражающие КПД цикла Карно через температуру и количество теплоты, то можно получить равенство: T2/T1 = Q2/Q1. Таким образом, для сравнения температур Т1 и Т2 двух тел необходимо осуществить обратимый цикл Карно, в котором одно тело (исследуемое) используется в качестве нагревателя, а второе (например, тающий лед) – в качестве холодильника. Термодинамической величиной будут являться количества теплоты Q1 и Q2. Согласно теоремам Карно химический состав рабочего тела не влияет на результаты сравнения температур, поэтому такая термодинамическая шкала не связана со свойствами какого-то определенного термометрического тела. Жидкостные термометры. Термометрическое тело – жидкость (пентан, этиловый спирт, толуол, ртуть), термометрическая величина – объем. Жидкость при нагревании расширяется больше чем стекло. Область применения жидкостных термометров (–200¼+600 °С) ограничена тем, что в области низких температур жидкости замерзают, а при высоких температурах стекло размягчается. Жидкостные термометры обладают невысокой точностью, так как тепловое расширение неодинаково (нелинейно) в широком диапазоне температур. В жидкостных манометрических термометрах давление расширяющейся от нагревания жидкости измеряется манометром, шкала которого проградуирована в единицах температуры. Существуют укороченные термометры (для увеличения точности отсчета по шкале). Например, термометр со шкалой от +50 до +100 °С; а при более низких температурах жидкость заполняет расширение внизу капиллярной трубки. Существуют максимальные термометры (например, медицинский), показывающие максимальную температуру. При нагревании ртуть продавливается через сужение в капиллярной трубке, а обратно ртуть не может опуститься из-за несмачивания стекла.
Разновидностью термометров сопротивления являются полупроводниковые терморезисторы, у которых при нагревании сопротивление уменьшается (рис. 74).
При температурах в тысячи градусов применяются неконтактные методы (так как нет таких тугоплавких термометров). Эти методы основаны на измерении испускаемого телом электромагнитного излучения. До 4000–6000 К используют пирометры, которые измеряют инфракрасное и видимое излучение (сплошной спектр). Свыше 6000 К излучение обусловлено процессами диссоциации и ионизации и используют спектроскопические методы (линейчатый спектр).
Существуют и другие методы измерения температуры, в которых используются зависимости от температуры частоты собственных колебаний различного рода резонаторов, скорости распространения звуковых волн, термодиоды, термотранзисторы, термокраски, термоиндикаторные пленки и т.п.
27. Симметрия кристаллов. Дефекты в кристаллах
1. Параллельный перенос всех точек тела на определенное расстояние (трансляция). Кристаллическая решетка обладает трансляционной симметрией (рис. 78). Это означает, что существуют 3 некомпланарных вектора 2. 3. Зеркальное отражение в плоскости. Плоскость называется плоскостью симметрии. 4. Инверсия или отражение в точке. Точка называется центром симметрии. 5.
|

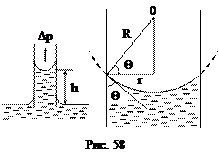 Используем формулу Лапласа для расчета высоты поднятия жидкости в цилиндрическом капилляре радиуса r (рис. 58). Пусть жидкость смачивает капилляр. Тогда жидкость образует вогнутый мениск.
Используем формулу Лапласа для расчета высоты поднятия жидкости в цилиндрическом капилляре радиуса r (рис. 58). Пусть жидкость смачивает капилляр. Тогда жидкость образует вогнутый мениск. .
.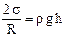 ,
, 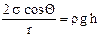 ,
, 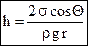 . (87)
. (87)
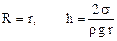 .
. , где d – расстояние между пластинами.
, где d – расстояние между пластинами. Пусть имеется герметический сосуд, частично заполненный жидкостью (рис. 60). Пусть первоначально в пространстве сосуда, свободном от жидкости, есть вакуум. Жидкость начнет испаряться и наступит динамическое равновесие – плотность пара перестанет изменяться. Пар, находящийся в равновесии со своей жидкостью, называется насыщенным. Давление, при котором наблюдается равновесие, называется давлением (упругостью) насыщенного пара.
Пусть имеется герметический сосуд, частично заполненный жидкостью (рис. 60). Пусть первоначально в пространстве сосуда, свободном от жидкости, есть вакуум. Жидкость начнет испаряться и наступит динамическое равновесие – плотность пара перестанет изменяться. Пар, находящийся в равновесии со своей жидкостью, называется насыщенным. Давление, при котором наблюдается равновесие, называется давлением (упругостью) насыщенного пара.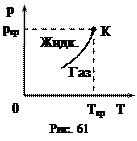 При увеличении температуры испарение увеличивается и возрастает давление насыщенного пара. Эта зависимость показана на рис. 61. Кривая фазового перехода "жидкость - пар" ограничена сверху критической точкой (К). Математически эта зависимость определяется уравнением Клапейрона-Клаузиуса:
При увеличении температуры испарение увеличивается и возрастает давление насыщенного пара. Эта зависимость показана на рис. 61. Кривая фазового перехода "жидкость - пар" ограничена сверху критической точкой (К). Математически эта зависимость определяется уравнением Клапейрона-Клаузиуса: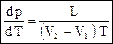 , (88)
, (88) Переход кристаллического тела в жидкое состояние (плавление) требует затраты некоторого количества теплоты, называемого теплотой плавления.
Переход кристаллического тела в жидкое состояние (плавление) требует затраты некоторого количества теплоты, называемого теплотой плавления.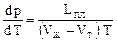 ,
,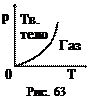 Переход твердого тела непосредственно в газообразное состояние называется сублимацией или возгонкой (например, "сухой лед" – углекислота). Испаряющиеся частицы твердого тела (аналогично жидкости) также могут образовывать насыщенный пар. Давление насыщенного пара возрастает при увеличении температуры (рис. 63). Возгонка так же, как и плавление, связана с разрушением кристаллической решетки и требует затраты для этого скрытой теплоты сублимации. Наклон кривой сублимации определяется уравнением Клапейрона-Клаузиуса. Для многих тел при нормальных условиях сублимация очень мала.
Переход твердого тела непосредственно в газообразное состояние называется сублимацией или возгонкой (например, "сухой лед" – углекислота). Испаряющиеся частицы твердого тела (аналогично жидкости) также могут образовывать насыщенный пар. Давление насыщенного пара возрастает при увеличении температуры (рис. 63). Возгонка так же, как и плавление, связана с разрушением кристаллической решетки и требует затраты для этого скрытой теплоты сублимации. Наклон кривой сублимации определяется уравнением Клапейрона-Клаузиуса. Для многих тел при нормальных условиях сублимация очень мала. Кривые плавления, парообразования и сублимации (линии равновесия между двумя фазами) пересекаются в тройной точке Тр (равновесие трех фаз). Кривые сублимации и парообразования имеют начало и конец (0, Тр, К). Кривая плавления конца не имеет.
Кривые плавления, парообразования и сублимации (линии равновесия между двумя фазами) пересекаются в тройной точке Тр (равновесие трех фаз). Кривые сублимации и парообразования имеют начало и конец (0, Тр, К). Кривая плавления конца не имеет. Поскольку кривая парообразования заканчивается в критической точке, возможен непрерывный переход вещества из жидкого состояния в газообразное и обратно. Такой переход не сопровождается фазовыми превращениями. Это связано с тем, что различие между газом и жидкостью является чисто количественным (большей или меньшей ролью взаимодействия между молекулами). Жидкости и газы – изотропны. А жидкости и кристаллы отличаются качественно – различной симметрией внутреннего строения.
Поскольку кривая парообразования заканчивается в критической точке, возможен непрерывный переход вещества из жидкого состояния в газообразное и обратно. Такой переход не сопровождается фазовыми превращениями. Это связано с тем, что различие между газом и жидкостью является чисто количественным (большей или меньшей ролью взаимодействия между молекулами). Жидкости и газы – изотропны. А жидкости и кристаллы отличаются качественно – различной симметрией внутреннего строения. Этот эффект объясняется зависимостью внутренней энергии реального газа не только от температуры, но и от объема, и наличием у молекул реального газа потенциальной энергии взаимодействия. Для идеального газа эффект Джоуля-Томсона отсутствует.
Этот эффект объясняется зависимостью внутренней энергии реального газа не только от температуры, но и от объема, и наличием у молекул реального газа потенциальной энергии взаимодействия. Для идеального газа эффект Джоуля-Томсона отсутствует.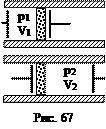 Поместим в теплоизолированную трубку воображаемые поршни (рис. 67). Пусть 1 моль газа, имеющего давление р1 и объем V1, надо переместить через перегородку. Для этого над газом надо совершить внешнюю работу (– р1V1). Справа от перегородки газ расширяется сам и совершает работу р2V2. Общая работа расширения газа равна
Поместим в теплоизолированную трубку воображаемые поршни (рис. 67). Пусть 1 моль газа, имеющего давление р1 и объем V1, надо переместить через перегородку. Для этого над газом надо совершить внешнюю работу (– р1V1). Справа от перегородки газ расширяется сам и совершает работу р2V2. Общая работа расширения газа равна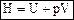 называется энтальпией (тепловой функцией или теплосодержанием и иногда обозначается буквой I).
называется энтальпией (тепловой функцией или теплосодержанием и иногда обозначается буквой I). Рассмотрим два идеализированных предельных случая.
Рассмотрим два идеализированных предельных случая. Þ;
Þ; 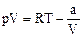 . (95)
. (95)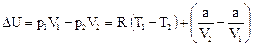 . (96)
. (96)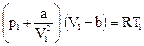 Þ;
Þ; 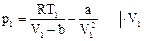
 ,
, 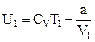 . (97)
. (97)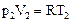 ,
, 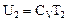 . (98)
. (98) . (99)
. (99)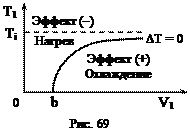
 . (100)
. (100) . Это наибольшее значение температуры, при котором возможно изменение знака эффекта, называется температурой инверсии Ti. Выше этой температуры эффект всегда отрицательный (газ нагревается). Как видно из рис. 69, для любого газа эффект Джоуля-Томсона может быть положительный, отрицательный или нулевой, если выбрать необходимые начальные условия Т1 и V1.
. Это наибольшее значение температуры, при котором возможно изменение знака эффекта, называется температурой инверсии Ti. Выше этой температуры эффект всегда отрицательный (газ нагревается). Как видно из рис. 69, для любого газа эффект Джоуля-Томсона может быть положительный, отрицательный или нулевой, если выбрать необходимые начальные условия Т1 и V1. , то получается простое соотношение
, то получается простое соотношение 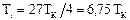 , которое удовлетворительно подтверждается на опыте.
, которое удовлетворительно подтверждается на опыте.
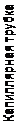
 По принципу испарения жидкости (фреона или хладона) работает компрессионный холодильник (рис. 70). Когда включается компрессор К, в трубках морозильной камеры давление быстро падает. Это заставляет фреон интенсивно испаряться (кипеть при пониженном давлении). Необходимая для испарения энергия берется из окружающей среды – морозильной камеры, которая охлаждается. После компрессора сжатый горячий фреон поступает в конденсатор, где он охлаждается и конденсируется, переходя в жидкое состояние. Охлажденный фреон поступает по капиллярной трубке в морозильную камеру, и процесс повторяется.
По принципу испарения жидкости (фреона или хладона) работает компрессионный холодильник (рис. 70). Когда включается компрессор К, в трубках морозильной камеры давление быстро падает. Это заставляет фреон интенсивно испаряться (кипеть при пониженном давлении). Необходимая для испарения энергия берется из окружающей среды – морозильной камеры, которая охлаждается. После компрессора сжатый горячий фреон поступает в конденсатор, где он охлаждается и конденсируется, переходя в жидкое состояние. Охлажденный фреон поступает по капиллярной трубке в морозильную камеру, и процесс повторяется.
 Устройство, в котором газ охлаждается в результате адиабатического расширения, называется детандером. Французскому инженеру Клоду удалось в 1902 г. с помощью такого метода получить жидкий воздух. Схема его установки аналогична машине Линде, но вместо дросселя использовался детандер – цилиндр с поршнем. Давление после компрессора составляло 40 атм, а после расширения – около 1 атм.
Устройство, в котором газ охлаждается в результате адиабатического расширения, называется детандером. Французскому инженеру Клоду удалось в 1902 г. с помощью такого метода получить жидкий воздух. Схема его установки аналогична машине Линде, но вместо дросселя использовался детандер – цилиндр с поршнем. Давление после компрессора составляло 40 атм, а после расширения – около 1 атм.
 Упрощенная схема газового термометра изображена на рис. 73. Он состоит из колбы с разряженным газом (водород, гелий, азот). Колба соединена с ртутным манометром тонкой трубкой. Поднимая и опуская трубку манометра, поддерживают постоянным объем газа (уровень ртути должен совпадать с опорной меткой). Высота столбика ртути покажет значение температуры газа в колбе. Достоинства: при малых давлениях все газы близки к идеальному и газовый термометр дает одинаковые показания независимо от используемого газа. Газовый термометр калибруется по реперным точкам, которыми являются тройные точки водорода, кислорода, воды, температуры плавления олова, цинка, серебра, золота.
Упрощенная схема газового термометра изображена на рис. 73. Он состоит из колбы с разряженным газом (водород, гелий, азот). Колба соединена с ртутным манометром тонкой трубкой. Поднимая и опуская трубку манометра, поддерживают постоянным объем газа (уровень ртути должен совпадать с опорной меткой). Высота столбика ртути покажет значение температуры газа в колбе. Достоинства: при малых давлениях все газы близки к идеальному и газовый термометр дает одинаковые показания независимо от используемого газа. Газовый термометр калибруется по реперным точкам, которыми являются тройные точки водорода, кислорода, воды, температуры плавления олова, цинка, серебра, золота. Термометры сопротивления. Термометрическое тело – металлическая проволока, термометрическая величина – электрическое сопротивление: R = RO(1+at). Наиболее часто применяется платина (–200¼+1100 °С) и медь (–200¼+100 °С).
Термометры сопротивления. Термометрическое тело – металлическая проволока, термометрическая величина – электрическое сопротивление: R = RO(1+at). Наиболее часто применяется платина (–200¼+1100 °С) и медь (–200¼+100 °С). Термопары (термоэлементы). Термоэлектричество (эффект Зеебека). Электрическая цепь составлена из двух разнородных проволок, сваренных концами (рис. 75). Если концы проволок имеют разные температуры Т1 и Т2, то возникает термоЭДС и в цепи идет ток. ТермоЭДС измеряется милливольтметром, включенным в разрыв цепи. Материалы для термопар: медь – константан, железо – константан, хромель – алюмель, хромель – копель, платина – (платина + 10% родия). Чувствительность термопар составляет 6–75 мкВ/К.
Термопары (термоэлементы). Термоэлектричество (эффект Зеебека). Электрическая цепь составлена из двух разнородных проволок, сваренных концами (рис. 75). Если концы проволок имеют разные температуры Т1 и Т2, то возникает термоЭДС и в цепи идет ток. ТермоЭДС измеряется милливольтметром, включенным в разрыв цепи. Материалы для термопар: медь – константан, железо – константан, хромель – алюмель, хромель – копель, платина – (платина + 10% родия). Чувствительность термопар составляет 6–75 мкВ/К. Биметаллический термометр представляет собой биметаллическую пластину, закрученную в спираль, один конец которой закреплен, а другой соединен со стрелкой (рис. 76).
Биметаллический термометр представляет собой биметаллическую пластину, закрученную в спираль, один конец которой закреплен, а другой соединен со стрелкой (рис. 76). Наиболее известны пирометры с исчезающей нитью накаливания, в которых изображение объекта 1 (рис. 77) при помощи объектива 2 совмещается с плоскостью нити лампы накаливания 4. Рассматривая изображение объекта и нити через красный светофильтр 5 и окуляр 6, наблюдатель сравнивает яркость измеряемого излучения и яркость контрольного излучателя – накаленной нити вольфрама. Если яркости одинаковы, то середина нити накаливания исчезнет (перестанет быть видимой) на фоне изображения измеряемого объекта. Выровнять яркости можно двумя способами: 1) менять ток через нить накаливания; 2) изменять яркость излучения перемещением нейтрального поглотителя с переменной плотностью (оптического клина) 3. Температура определяется по шкале отсчетного устройства, регистрирующего положение клина или ток накала лампы.
Наиболее известны пирометры с исчезающей нитью накаливания, в которых изображение объекта 1 (рис. 77) при помощи объектива 2 совмещается с плоскостью нити лампы накаливания 4. Рассматривая изображение объекта и нити через красный светофильтр 5 и окуляр 6, наблюдатель сравнивает яркость измеряемого излучения и яркость контрольного излучателя – накаленной нити вольфрама. Если яркости одинаковы, то середина нити накаливания исчезнет (перестанет быть видимой) на фоне изображения измеряемого объекта. Выровнять яркости можно двумя способами: 1) менять ток через нить накаливания; 2) изменять яркость излучения перемещением нейтрального поглотителя с переменной плотностью (оптического клина) 3. Температура определяется по шкале отсчетного устройства, регистрирующего положение клина или ток накала лампы. Под симметрией тела понимается его способность совмещаться с самим собой при определенных преобразованиях. К преобразованиям симметрии относятся:
Под симметрией тела понимается его способность совмещаться с самим собой при определенных преобразованиях. К преобразованиям симметрии относятся: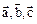 , характеризующихся тем, что при смещении решетки на вектор трансляции
, характеризующихся тем, что при смещении решетки на вектор трансляции 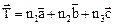 она переходит сама в себя (n1, n2, n3 – целые числа). Базисные вектора
она переходит сама в себя (n1, n2, n3 – целые числа). Базисные вектора  называют основными периодами решетки, а построенный ими параллелепипед – элементарной ячейкой.
называют основными периодами решетки, а построенный ими параллелепипед – элементарной ячейкой. Поворот тела вокруг некоторой оси на определенный угол. Если тело совмещается с самим собой при повороте вокруг некоторой оси на угол 2p/n, то эта ось называется осью симметрии n-го порядка. Кроме тривиальной оси 1-го порядка, возможны только оси симметрии 2, 3, 4 и 6-го порядков (рис. 79). Не бывает осей 5-го порядка и более высокого, чем 6 (так как нельзя заполнить полностью всю плоскость (без пустых промежутков) пятиугольниками, семиугольниками и т.п.).
Поворот тела вокруг некоторой оси на определенный угол. Если тело совмещается с самим собой при повороте вокруг некоторой оси на угол 2p/n, то эта ось называется осью симметрии n-го порядка. Кроме тривиальной оси 1-го порядка, возможны только оси симметрии 2, 3, 4 и 6-го порядков (рис. 79). Не бывает осей 5-го порядка и более высокого, чем 6 (так как нельзя заполнить полностью всю плоскость (без пустых промежутков) пятиугольниками, семиугольниками и т.п.). Комбинация этих преобразований. Например, если тело совмещается с самим собой при повороте на угол 2p/n и отражении в плоскости, перпенди
Комбинация этих преобразований. Например, если тело совмещается с самим собой при повороте на угол 2p/n и отражении в плоскости, перпенди


