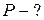Уравнение состояния идеального газа. Уравнение состояния идеального газа
МОЛЕКУЛЯРНАЯ ФИЗИКА ГЛАВА 6. КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ Уравнение состояния идеального газа Согласно кинетической теории газ представляет собой большое число молекул, находящихся в непрерывном хаотическом тепловом движении. Свойства газов (например, давление и температура) являются суммарным результатом действия молекул. Рассмотрим модель идеального газа. Согласно этой модели молекулы газа - это маленькие шарики, суммарный объем которых всегда пренебрежимо мал по сравнению с объемом сосуда, в котором они находятся. Шарики не взаимодействуют между собой на расстоянии, а только непрерывно упруго сталкиваются друг с другом, двигаясь до соудорения прямолинейно и равномерно. Получим уравнение состояния идеального газа - уравнение, связывающее параметры состояния газа - давления Опыт показывает, что при небольших давлениях легкие газы, с хорошей точностью подчиняются уравнению
(15. 1) называемому уравнением Клапейрона. Следовательно, уравнение (15. 1) можно считать уравнением состояния идеального газа. Постоянная Обозначим через
откуда
(15. 2)
где постоянная согласно закону Авогардо моли различных газов при одинаковых давлениях и температурах имеют одинаковый объем, постоянная
(15. 3)
не зависит от химического состава газа, т.е. одинакова для всех газов. Поэтому её принято называть универсальной газовой постоянной. Найдем численное значение
Подставляя
называемое уравнением Клапейрона - Менделеева. Пример 15. 1. В баллоне вместимостью
(см. Приложение2)
Ответ: Пример 15. 2. В баллонах объемом
. Ответ:
|

 . объем
. объем  и температуру
и температуру 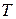 (в кельвинах).
(в кельвинах).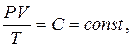
 зависит от химического состава и количества газа.
зависит от химического состава и количества газа.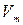 объема одного моля газа. Подставляя
объема одного моля газа. Подставляя 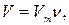 где
где 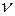 - число молей газа, в уравнение (15. 1), имеем
- число молей газа, в уравнение (15. 1), имеем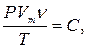

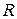 не зависит от количества газа. Кроме того, так как
не зависит от количества газа. Кроме того, так как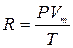
 1атм =
1атм = 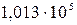 Па,
Па,  . Согласно соотношению (15. 3)
. Согласно соотношению (15. 3)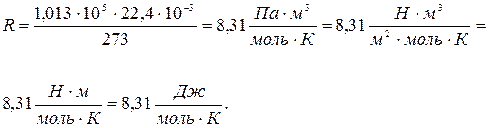
 в уравнение (15. 1), получаем уравнение состояния идеального газа
в уравнение (15. 1), получаем уравнение состояния идеального газа
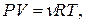 (15.4)
(15.4)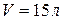 находится аргон под давлением
находится аргон под давлением  и при температуре
и при температуре 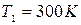 . Когда из баллона было взято некоторое количество газа, давление в баллоне понизилось до
. Когда из баллона было взято некоторое количество газа, давление в баллоне понизилось до  , а температура установилась
, а температура установилась 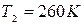 . Определить массу
. Определить массу 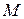 аргона, взятого из баллона.
аргона, взятого из баллона.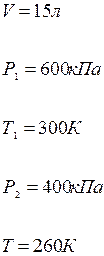
 (Масса газа
(Масса газа 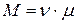 , где
, где  - масса моля
газа,
- масса моля
газа, 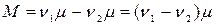 .
.
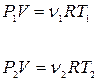
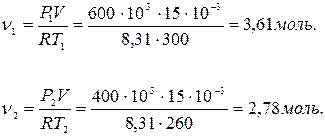


 и
и  содержиться газ. Давление в первом баллоне
содержиться газ. Давление в первом баллоне  , во втором -
, во втором -  . Определить давление
. Определить давление 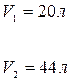
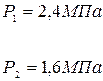
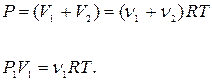
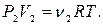
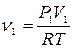 ,
, 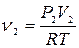 .
.