Химические свойства. 1. Кислотные свойства у фенолов выражены сильнее, чем у спиртов
1. Кислотные свойства у фенолов выражены сильнее, чем у спиртов. В результате сопряжения неподелённой пары электронов кислородного атома с p- электронной системой ароматического кольца, электронная плотность О-атома перемещается частично на связь С–О, увеличивая при этом электронную плотность в бензольном ядре (в особенности в орто- и пара-положениях). Электронная пара связи О–Н сильнее притягивается к атому кислорода, способствуя тем самым созданию большего положительного заряда на атоме водорода гидроксильной группы и, следовательно, отщеплению этого водорода в виде протона.
Фенолы, в отличие от спиртов, образуют феноляты не только при взаимодействии с активными металлами, но и с водными растворами щелочей.
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией, идентифицирующей фенолы:
Фенолы – очень слабые кислоты, поэтому феноляты легко гидролизуются и разрушаются не только сильными, но и очень слабыми кислотами:
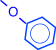
Фенолы образуют простые эфиры (синтез Вильямсона) и сложные эфиры
и сложные эфиры
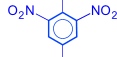
2. Реакции бензольного кольца. Гидроксильная группа у фенолов является очень сильным орто- и пара-ориентантом. Реакции замещения атомов водорода в бензольном кольце протекают в более мягких условиях, чем у бензола. При бромировании и нитровании могут быть получены 2,4,6-тризамещенные производные
3. Гидрирование.
Применение
Фенол применяется при производстве фенолформальдегидных смол, в фармацевтической промышленности и как антисептик (карболовая кислота). Гидрохинон (1,4-диоксибензол) – проявитель в фотографии.
|

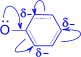


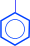

 (циклогексанол)
(циклогексанол)



