Диссоциация воды. Водородный показатель
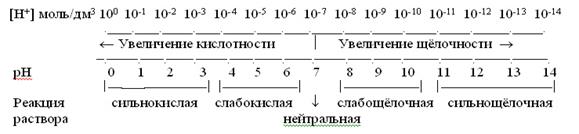
Вода служит не только наиболее распространенным растворителем для многих веществ, но и сама является очень слабым амфотерным электролитом: Н2О ↔ H+ + ОH-; ∆Н°298 = 56 кДж /моль, в воде присутствуют катионы водорода и гидроксид - анионы в строго эквивалентных количествах. Константа ионизации воды (Кu) Ku = [H][OH-]/[H2O], определена по электрической проводимости и равна 1,8∙10-16 при 22 °С. Так как вода - очень слабый электролит, то концентрация недиссоциированных молекул может быть принята равной общему числу молей в 1 дм3 воды, то есть: [Н2О] = 1000/18 = 55,56 моль/дм3. Тогда Ки [Н20]= [H+] [ОН-] или [H+][ОН-] = 1,8∙10-16 ∙55,56 = 10-14 = Кw Величина [Н+ ][ОН-] = 10-14 называется ионным произведением воды. Так как в воде концентрации гидратированных ионов равны, то ____ [H+]= [ОH-]= √10-14 = 10-7 моль/дм3 При добавлении кислоты концентрация ионов водорода увеличивается и соответственно уменьшается концентрация гидроксид – ионов, поскольку при данной температуре ионное произведение воды – величина постоянная. При добавлении щелочи наблюдается обратная зависимость. Таким образом, концентрация ионов водорода в растворе может служить мерой кислотности или щелочности среды. В кислых растворах [Н+]>10-7, в щелочных [Н+]<10-7. В 1909 г. Сёренсен ввел значение отрицательного десятичного логарифма концентрации водородных ионов, которое называют водородным показателем рН рН= - lg[H+]. Тогда для нейтральной среды рН = - lg10-7 = 7, для кислых растворов рН < 7, а для щелочных рН > 7. Аналогичным образом реакция среды может быть охарактеризована так называемым гидроксильным показателем рОН рОН = -lg[OH-]. Для воды рН = рОН = 7, а изменение рОН в кислых и щелочных растворах противоположно изменению рН. Прологарифмировав ионное произведение воды, получим lg[H+] + lg[OH-] = -14. Заменив отрицательные логарифмы, получим соотношение рН + рОН = 14. Наглядно зависимость между концентрацией ионов водорода, значением рН и реакцией раствора можно выразить схемой:
Из схемы видно, что чем меньше рН, тем больше концентрация ионов Н+, т.е. тем выше кислотность среды; и наоборот, чем больше рН, тем меньше концентрация ионов Н+, т.е. тем выше щелочность среды. Исключительно важна роль реакции среды в самых различных явлениях и процессах, как в природе, так и в медицинской практике. Многие процессы, протекающие в живых организмах, требуют определенной реакции среды.
|