Избыточные термодинамические величины
– Задача. Определить избыточную энергию Гиббса, избыточную энтропию и энтальпию расплавов Fe–Ni по значениям активностей и теплот растворения железа и никеля. – Исходные данные. Активности железа и никеля (стандартное состояние - чистые жидкие железо и никель) и их теплоты растворения (относительные парциальные энтальпии) в расплавах Fe–Ni при 1873 К [1] представлены в таблице.
– Теория. Избыточные термодинамические величины характеризуют отклонение реального раствора от идеального. При образовании идеального совершенного раствора энтальпии компонентов не изменяются, так что мольная энтальпия бинарного совершенного раствора
– где
– Поэтому ненулевые энтальпии – всегда избыточные. Их называют просто энтальпиями (парциальными или интегральными). – Энтропия при образовании совершенного раствора увеличивается, поскольку повышается термодинамическая вероятность, которая характеризуется числом способов реализации данного энергетического состояния системы. (Например, в бинарном идеальном растворе перестановка двух разнородных атомов приводит к новому состоянию раствора, хотя его энергия не изменяется.)
– Относительная парциальная мольная энтропия компонента совершенного раствора
– Из уравнений (1.2) – (1.4)
– Относительные парциальная и интегральная энергии Гиббса реального раствора равны:
– где ai - активность компонента i, ai = g iхi; g i - коэффициент активности компонента i. – Избыточные термодинамические величины – избыточная парциальная энергия Гиббса
– избыточная парциальная энтропия
– Аналогично определяют избыточные интегральные термодинамические величины:
Решение. Рассчитаем избыточные интегральные мольные термодинамические характеристики расплава Fe–Ni эквиатомного состава (x Fe = x Ni = 0,5). Избыточную энергию Гиббса определяем по уравнению
– Энтальпия образования расплава равна относительной мольной интегральной энтальпии или просто теплоте образования:
– Избыточную энтропию при T = 1873 К вычисляем по уравнению
– Результаты расчета избыточных термодинамических характеристик расплавов Fe–Ni в зависимости от состава приведены на рисунке. – – 2. Были рассмотрены избыточные термодинамические величины относительно совершенного раствора. Моделью идеального раствора может служить также разбавленный раствор, подчиняющийся закону Генри. Отклонения от закона Генри характеризуются коэффициентом активности fi. В этом случае
|

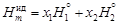 ,
,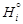 - энтальпия чистого компонента i. Относительные интегральная энтальпия и парциальные энтальпии компонентов в совершенном растворе равны нулю:
- энтальпия чистого компонента i. Относительные интегральная энтальпия и парциальные энтальпии компонентов в совершенном растворе равны нулю: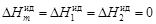 . (1.2)
. (1.2) . (1.3)
. (1.3) . (1.4)
. (1.4) ;
; .
. ;
;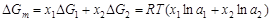 ,
,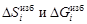 представляют собой разность между соответствующими относительными парциальными или интегральными величинами для реального и идеального растворов:
представляют собой разность между соответствующими относительными парциальными или интегральными величинами для реального и идеального растворов: ;
;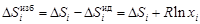 .
. (1.5)
(1.5)


 Примечания. 1. При g i < 1 (
Примечания. 1. При g i < 1 (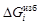 < 0) имеет место отрицательное отклонение от закона Рауля, при g i > 1 (
< 0) имеет место отрицательное отклонение от закона Рауля, при g i > 1 (


