Аморфные тела
Как в жидкостях, так и в твердых телах всегда имеется некоторое число молекул, энергия которых достаточна для преодоления притяжения к другим молекулам и которые способны ото- рваться от поверхности жидкости или
Испарение жидкостей идет при лю- бой температуре, но его интенсивность с повышением температуры возрастает. Наряду с процессом испарения проис- ходит компенсирующий его процесс конденсации пара в жидкость. Если число молекул, покидающих жидкость за единицу времени через единицу по- верхности, равно числу молекул, пере- ходящих из пара в жидкость, то насту- пает динамическое равновесие между процессами испарения и конденсации. Пар, находящийся в равновесии со сво- ей жидкостью, называется насыщен- ным (см. § 62). Для большинства твердых тел про- цесс сублимации при обычных темпе- ратурах незначителен и давление пара над поверхностью твердого тела мало; оно увеличивается с повышением тем- пературы. Интенсивно сублимируют такие вещества, как нафталин, камфо- ра, что обнаруживается по резкому, свойственному им запаху. Особенно интенсивно сублимация происходит в вакууме, что используется для изготов- ления зеркал. Известный пример суб- лимации — превращение льда в пар — мокрое белье высыхает на морозе. Если, твердое тело нагревать, то его внутренняя энергия (складывается из энергии колебаний частиц в узлах ре- шетки и энергии взаимодействия этих частиц) возрастает. При повышении температуры амплитуда колебаний ча- стиц увеличивается до тех пор, пока кристаллическая решетка не разрушит- ся, — твердое тело плавится. На рис. 116, а изображена примерная зависи- мость T(Q), где Q — количество тепло- ты, получаемое телом при плавлении.
Рис.116
По мере сообщения твердому телу теп- лоты его температура повышается, а при температуре плавления
поскольку энергия частиц вещества должна быть достаточной для разруше- ния кристаллической решетки. В про- цессе плавления теплота, сообщаемая веществу, идет на совершение работы по разрушению кристаллической ре- шетки, а поэтому Если жидкость охлаждать, то про- цесс протекает в обратном направлении (рис. 116,
трое кристаллизации — кристалли- ческих зародышей, которыми могут быть не только кристаллики образую- щегося вещества, но и примеси, а так- же пыль, сажа и т.д. Отсутствие цент- ров кристаллизации в чистой жидкости затрудняет образование микроскопи- ческих кристалликов, и вещество, оста- ваясь в жидком состоянии, охлаждает- ся до температуры, меньшей темпера- туры кристаллизации, при этом образу- ется переохлажденная жидкость (на рис. 116, б ей соответствует штриховая кривая). При сильном переохлаждении начинается спонтанное образование центров кристаллизации и вещество кристаллизуется довольно быстро. Обычно переохлаждение расплава происходит от долей до десятков гра- дусов, но для ряда веществ может дос- тигать сотен градусов. Из-за большой вязкости сильно переохлажденные жидкости теряют текучесть, сохраняя, как и твердые тела, свою форму. Эти тела получили название аморфных твердых тел; к ним относятся смолы, воск, сургуч, стекло. Аморфные тела, являясь, таким образом, переохлажден- ными жидкостями, изотропны, т.е. их свойства во всех направлениях одина- ковы; для них, как и для жидкостей, характерен ближний порядок в располо- жении частиц; в них в отличие от жид- костей подвижность частиц довольно мала. Особенностью аморфных тел явля- ется отсутствие у них определенной точки плавления, т. е. невозможно ука- зать определенную температуру, выше которой можно было бы констатиро- вать жидкое состояние, а ниже — твер- дое. Из опыта известно, что в аморфных телах со временем может наблюдаться процесс кристаллизации, например в стекле появляются кристаллики; оно, теряя прозрачность, начинает мутнеть и превращаться в поликристаллическое тело. Широкое распространение получи- ли полимеры — органические аморф- ные тела, молекулы которых состоят из большого числа одинаковых длинных молекулярных цепочек, соединенных химическими (валентными) связями. К полимерам относятся как естествен- ные (крахмал, белок, каучук, клетчатка и др.), так и искусственные (пластмас- са, резина, полистирол, лавсан, капрон и др.) органические вещества. Полимерам присущи прочность и эластичность; некоторые полимеры вы- держивают растяжение, в 5 —10 раз пре- вышающее их первоначальную длину. Это объясняется тем, что длинные мо- лекулярные цепочки могут при дефор- мации либо сворачиваться в плотные клубки, либо вытягиваться в прямые линии. Эластичность полимеров прояв- ляется только в определенном интерва- ле температур, ниже которого они ста- новятся твердыми и хрупкими, а выше — пластичными. Хотя синтетических полимерных материалов создано очень много (искусственные волокна, замени- тели кожи, строительные материалы, заменители металлов и др.), но теория полимеров до настоящего времени пол- ностью не разработана. Ее развитие оп- ределяется запросами современной тех- ники, требующей синтеза полимеров с заранее заданными свойствами.
§ 75. Фазовые переходы I и II рода
Фазой называется термодинамичес- ки равновесное состояние вещества, отличающееся по физическим свой- ствам от других возможных равновес- ных состояний того же вещества. Если, например, в закрытом сосуде находит-
ся вода, то эта система является двух- фазной: жидкая фаза — вода, газообраз- ная фаза — смесь воздуха с водяными парами. Если в воду бросить кусочки льда, то эта система станет трехфазной, в которой лед является твердой фазой. Часто понятие «фаза» употребляет- ся в смысле агрегатного состояния, од- нако надо учитывать, что оно шире, чем понятие «агрегатное состояние». В пре- делах одного агрегатного состояния ве- щество может находиться в нескольких фазах, отличающихся по своим свой- ствам, составу и строению (лед, напри- мер, встречается в пяти различных мо- дификациях — фазах). Переход вещества из одной фазы в другую — фазовый переход — всегда связан с качественными изменениями свойств вещества. Примером фазового перехода могут служить изменения аг- регатного состояния вещества или пе- реходы, связанные с изменениями в со- ставе, строении и свойствах вещества (например, переход кристаллического вещества из одной модификации в дру- гую). Различают фазовые переходы двух родов. Фазовый переход I рода (на- пример, плавление, кристаллизация) сопровождается поглощением или вы- делением теплоты, называемой тепло- той фазового перехода. Фазовые пе- реходы I рода характеризуются посто- янством температуры, изменениями эн- тропии и объема. Объяснение этому можно дать следующим образом. На- пример, при плавлении телу нужно со- общить некоторое количество теплоты, чтобы вызвать разрушение кристалли- ческой решетки. Подводимая при плав- лении теплота идет не на нагрев тела, а на разрыв межатомных связей, поэто- му плавление протекает при постоян- ной температуре. В подобных перехо- дах — из более упорядоченного крис- таллического состояния в менее упоря- доченное жидкое состояние — степень беспорядка увеличивается, т. е., соглас- но второму началу термодинамики, этот процесс связан с возрастанием эн- тропии системы. Если переход происхо- дит в обратном направлении (кристал- лизация), то система выделяет теплоту. Фазовые переходы, не связанные с поглощением или выделением теплоты и изменением объема, называются фа- зовыми переходам II рода. Эти пере- ходы характеризуются постоянством объема и энтропии, но скачкообраз- ным изменением теплоемкости. Общая трактовка фазовых переходов II рода предложена академиком Л.Д.Ландау (1908—1968). Согласно этой трактов- ке, фазовые переходы
§ 76. Диаграмма состояния.
|

 твердого тела и в окружающее их пространство. Этот процесс для жид- кости называется испарением (или па- рообразованием), для твердых тел — сублимацией (или возгонкой).
твердого тела и в окружающее их пространство. Этот процесс для жид- кости называется испарением (или па- рообразованием), для твердых тел — сублимацией (или возгонкой).
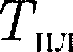 начи- нается переход тела из твердого состо- яния в жидкое. Температура
начи- нается переход тела из твердого состо- яния в жидкое. Температура  оста- ется постоянной до тех пор, пока весь кристалл не расплавится, и только тог- да температура жидкости вновь начнет повышаться.
оста- ется постоянной до тех пор, пока весь кристалл не расплавится, и только тог- да температура жидкости вновь начнет повышаться. Нагревание твердого тела до
Нагревание твердого тела до  еще не переводит его в жидкое
еще не переводит его в жидкое — const до рас- плавления всего кристалла. Затем под- водимая теплота опять пойдет на уве- личение энергии частиц жидкости и ее температура начнет повышаться. Коли- чество теплоты, необходимое для рас- плавления 1 кг вещества, называется удельной теплотой плавления.
— const до рас- плавления всего кристалла. Затем под- водимая теплота опять пойдет на уве- личение энергии частиц жидкости и ее температура начнет повышаться. Коли- чество теплоты, необходимое для рас- плавления 1 кг вещества, называется удельной теплотой плавления. Q' — количество теплоты, отдаваемое телом при кристаллиза- ции): сначала температура жидкости понижается, затем при постоянной тем- пературе, равной
Q' — количество теплоты, отдаваемое телом при кристаллиза- ции): сначала температура жидкости понижается, затем при постоянной тем- пературе, равной 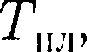 начинается крис- таллизация, после ее завершения тем- пература кристалла начнет понижаться. Для кристаллизации вещества необ- ходимо наличие так называемых цен-
начинается крис- таллизация, после ее завершения тем- пература кристалла начнет понижаться. Для кристаллизации вещества необ- ходимо наличие так называемых цен- рода связаны с изменением симметрии: выше точки пе- рехода система, как правило, обладает более высокой симметрией, чем ниже точки перехода. Примерами фазовых переходов II рода являются: переход ферромагнитных веществ (железа, ни-
рода связаны с изменением симметрии: выше точки пе- рехода система, как правило, обладает более высокой симметрией, чем ниже точки перехода. Примерами фазовых переходов II рода являются: переход ферромагнитных веществ (железа, ни- келя) при определенных давлении температуре в парамагнитное состоя- ние; переход металлов и некоторых сплавов при температуре, близкой к 0 К, в сверхпроводящее состояние, ха- рактеризуемое скачкообразным умень- шением электрического сопротивления до нуля; превращение обыкновенного жидкого гелия (гелия I) при Т = 2,9 К в другую жидкую модификацию (гелий II), обладающую свойствами сверхтеку- чести.
келя) при определенных давлении температуре в парамагнитное состоя- ние; переход металлов и некоторых сплавов при температуре, близкой к 0 К, в сверхпроводящее состояние, ха- рактеризуемое скачкообразным умень- шением электрического сопротивления до нуля; превращение обыкновенного жидкого гелия (гелия I) при Т = 2,9 К в другую жидкую модификацию (гелий II), обладающую свойствами сверхтеку- чести.


