Тройная точка
тием агрегатного состояния. Согласно § 60, одно и то же вещество в зависимо- сти от соотношения между удвоенной средней энергией, приходящейся па одну степень свободы хаотического (теплового) движения молекул, и наи- меньшей потенциальной энергией вза- имодействия молекул может находить- ся в одном из трех агрегатных состоя- нии: твердом, жидком или газообраз- ном. Это соотношение, в свою очередь, определяется внешними условиями — температурой и давлением. Следова- тельно, фазовые превращения также определяются изменениями температу- ры и давления. Для наглядного изображения фазо- вых превращений используется диаг- рамма состояния (рис. 117), на кото- рой в координатах р, Т задается зави- симость между температурой фазового перехода и давлением в виде кривых ис- парения (КИ), плавления (КП) и суб- лимации (КС), разделяющих поле ди- аграммы на три области, соответству- ющие условиям существования твер- дой (ТТ), жидкой (Ж) и газообразной (Г) фаз. Кривые на диаграмме называ- ются кривыми фазового равновесия, каждая точка на них соответствует ус- ловиям равновесия двух сосуществую- щих фаз: КП — твердого тела и жидко- сти, КИ — жидкости и газа, КС — твер- дого тела и газа. Точка, в которой пересекаются эти кривые и которая, следовательно, оп- ределяет условия (температуру Ттри соответствующее ей равновесное дав- ление ения термодинамической температур- ной шкалы. Термодинамика дает метод расчета кривой равновесия двух фаз одного и того же вещества. Согласно уравнению Клапейрона — Клаузиуса, производ- ная от равновесного давления по тем- пературе равна
где L — теплота фазового перехода; Т — температура перехода (процесс изотер- мический);
> 0; следовательно в этих процес- сах повышение температуры приводит к увеличению давления, и наоборот. При плавлении большинства веществ объем, как правило, возрастает, т.е.
Рис.118 т.е. Диаграмма состояния, строящаяся па основе экспериментальных данных, по- зволяет судить, в каком состоянии на- ходится данное вещество при опреде- ленных р и Г, а также какие фазовые пе- реходы будут происходить при том или ином процессе. Например, при услови- ях, соответствующих точке 1 (рис. 1 18), вещество находится в твердом состоя- нии, точке 2 — в газообразном, а точке 3 ~ одновременно в жидком и газооб- разном состояниях. Допустим, что вещество в твердом состоянии, соответствующем точке 4, подвергается изобарному нагреванию, изображенному на диаграмме состоя- ния горизонтальной штриховой пря- мой 4 — 5—6. Из рисунка видно, что при температуре, соответствующей точке 5, вещество плавится, при более высокой температуре, соответствующей точке б, начинает превращаться в газ. Если же вещество находится в твер- дом состоянии, соответствующем точ- ке 7, то при изобарном нагревании (штриховая прямая 7 — 8) кристалл превращается в газ, минуя жидкую фазу. Если вещество находится в состоянии, соответствующем точке 9, то при изо- термическом сжатии (штриховая пря- мая 9 — 10) оно пройдет следующие три состояния: газообразное — жидкое — кристаллическое. На диаграмме состояний (см. рис. 117 и 118) видно, что кривая испарения за- канчивается в критической точке К. По- этому возможен непрерывный переход вещества из жидкого состояния в газо- образное и обратно в обход критической точки без пересечения кривой испаре- ния (переход 11—12 на рис. 118), т.е. такой переход, который не сопровожда- ется фазовыми превращениями. Это возможно благодаря тому, что различие между газом и жидкостью является чи- сто количественным (оба эти состояния, например, являются изотропными).
|

 Если система является однокомпо- нентной, т.е. состоящей из химически однородного вещества или его соедине- ния, то понятие фазы совпадает с
Если система является однокомпо- нентной, т.е. состоящей из химически однородного вещества или его соедине- ния, то понятие фазы совпадает с одновременного равновес- ного сосуществования трех фаз веще- ства, называется тройной точкой. Каждое вещество имеет только одну тройную точку. Тройная точка воды соответствует температуре 273,16 К (или температуре 0,01 °С) и является основной реперной точкой для постро-
одновременного равновес- ного сосуществования трех фаз веще- ства, называется тройной точкой. Каждое вещество имеет только одну тройную точку. Тройная точка воды соответствует температуре 273,16 К (или температуре 0,01 °С) и является основной реперной точкой для постро-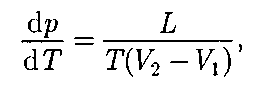 (76.1)
(76.1) —
—  — изменение объе- ма вещества при переходе его из первой фазы во вторую.
— изменение объе- ма вещества при переходе его из первой фазы во вторую.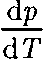 Уравнение Клапейрона — Клаузиуса позволяет определить наклоны кривых равновесия. Поскольку L и Т положи- тельны, наклонзадаетсязнаком
Уравнение Клапейрона — Клаузиуса позволяет определить наклоны кривых равновесия. Поскольку L и Т положи- тельны, наклонзадаетсязнаком 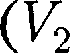 —
— 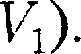 При испарении жидкостей и сублима- ции твердых тел объем вещества всегда возрастает, поэтому согласно (76.1),
При испарении жидкостей и сублима- ции твердых тел объем вещества всегда возрастает, поэтому согласно (76.1),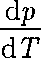 >0; следовательно, увеличение давления приводит к повышению тем- пературы плавления (сплошная линия КП на рис. 117). Для некоторых же ве- ществ (Н2О, Ge, чугун и др.) объем жид- кой фазы меньше объема твердой фазы,
>0; следовательно, увеличение давления приводит к повышению тем- пературы плавления (сплошная линия КП на рис. 117). Для некоторых же ве- ществ (Н2О, Ge, чугун и др.) объем жид- кой фазы меньше объема твердой фазы,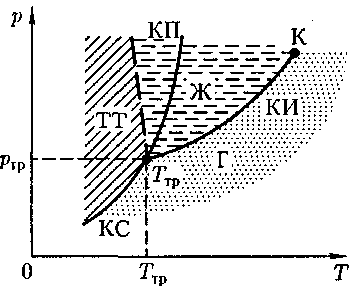 Рис.117
Рис.117
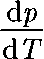 < 0; следовательно, увеличение давления сопровождается понижением температуры плавления (штриховая линия на рис. 117).
< 0; следовательно, увеличение давления сопровождается понижением температуры плавления (штриховая линия на рис. 117). Переход же кристаллического состо- яния (характеризуется анизотропией) в жидкое или газообразное может быть только скачкообразным (в результате фазового перехода), поэтому кривые плавления и сублимации могут об- рываться, как это имеет место для кри- вой испарения в критической точке. Кривая плавления уходит в бесконеч- ность, а кривая сублимации идет в точ- ку, где р=О и Т=О К.
Переход же кристаллического состо- яния (характеризуется анизотропией) в жидкое или газообразное может быть только скачкообразным (в результате фазового перехода), поэтому кривые плавления и сублимации могут об- рываться, как это имеет место для кри- вой испарения в критической точке. Кривая плавления уходит в бесконеч- ность, а кривая сублимации идет в точ- ку, где р=О и Т=О К.


