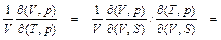Внутренняя энергия как термодинамический потенциал
К числу термодинамических потенциалов относится внутренняя энергия, заданная как функция энтропии и объема (35.5). Параметры S и V являются естественными переменными для U. Дифференциал внутренней энергии определяется основным уравнением (29.9), и он полный. Это дает соотношение взаимности (35.7), называемое также соотношением Максвелла. Простое дифференцирование U (S, V) по S и V позволяет получить систему двух уравнений (см. соотношения (35.6))
T = (¶ U /¶ S) V = T (S, V), p = – (¶ U / ¶ V) S = p (S, V), (37.1)
которую можно рассматривать как параметрическое задание термического уравнения состояния. Если из первого уравнения этой системы выразить энтропию через температуру и объем и подставить во второе уравнение, то термическое уравнение состояния примет обычный вид p = p (T, V). Исключая S из выражения (35.5) для U, можно получить калорическое уравнение состояния U = U (T, V). С помощью операции дифференцирования и арифметических операций могут быть найдены все термодинамические величины, характеризующие физическую систему. Пусть, к примеру, требуется найти теплоемкость при постоянном объеме. Так как для равновесных процессов δ Q = TdS, то теплоемкость системы связана с энтропией соотношением c x = T (¶ S /¶ T)x и, в частности,
cV = T (¶ S / ¶ T) V. (37.2)
Поэтому
cV = T (¶ S / ¶ T) V = (¶ U / ¶ T) V = (¶ U / ¶ S) V / (¶2 U / ¶ S 2) V.
Или пусть интерес представляет изобарический коэффициент объемного расширения α p = V –1(¶ V / ¶ T) p:
α p =
= V –1(¶ p / ¶ S) V / ((¶ T / ¶ V) S (¶ p / ¶ S) V – (¶ T / ¶ S) V (¶ p / ¶ V) S) =
= V –1¶2 U / (¶ S ¶ V) / ((¶2 U / (¶ S ¶ V))2 – (¶2 U / ¶ S 2) V (¶2 U / ¶ V 2) S) и т. д. При адиабатическом процессе δ A = pdV = – dU, т. е. система совершает работу за счет внутренней энергии. Поэтому внутреннюю энергию называют также адиабатическим потенциалом.
|