КИСЛОТЫ
Кислоты – это сложные соединения, состоящие из одного или нескольких атомов водорода и кислотного остатка. С точки зрения теории электролитической диссоциации кислоты – это электролиты, которые в растворах и расплавах в качестве катионов образуют только катионы водорода Н+: HNO3 = H+ + NO3- HClO4 = H+ + ClO4- Кислоты характеризуются основностью. Основность определяется числом атомов водорода, способных замещаться на атомы металлов в химических взаимодействиях. По основности кислоты делят на одноосновные (HCl, HNO3, HClO4, CH3COOH и др.), двухосновные (H2SO4, H2SO3, H2SiO3 и др.), трехосновные (H3PO4, H3BO3) и т.д. Многоосновные кислоты диссоциируют ступенчато. H2SO3 = H+ + HSO3- Н 3PO4 = H+ + H2PO4- HSO3- = H+ + SO32- H2PO4- = H+ + HPO42- H2PO42- = H+ + PO43- Многоосновная кислота в химической реакции не всегда проявляет свою максимальную основность. Например, серная кислота при взаимодействии с гидроксидом натрия может проявлять основность равную 1 и 2: H2SO4 + 2NaOH = Na2SO4 + 2H2O двухосновная H2SO4 + NaOH = NaНSO4 + H2O одноосновная По наличию атомов кислорода в своем составе кислоты делят на кислородсодержащие (H3PO4, HNO3, CH3COOH) и бескислородные (HCl, HBr, H2S). Номенклатура кислот прошла долгий путь развития и складывалась постепенно. Поэтому ряд названий (серная, азотная, фосфорная и др.) сохраняются и в современной номенклатуре ИЮПАК наряду с систематическими названиями. Систематические названия становятся полезными тогда, когда речь идет о менее распространенных кислотах, а также, образованных элементами с переменной степенью окисления. В этих случаях традиционные названия требуют запоминания относящихся к ним формул, в то время как из систематических названий формулу можно вывести. То же относится и к солям менее распространенных кислот. Например, систематическими будут названия: H2MnO4 – тетраоксоманганат (VI) водорода, HMnO4 – тетраоксоманганат (VII) водорода. В случае бескислородных кислот к названию элемента (или группы элементов), образующего кислоту, добавляют соединительную гласную -о-,слово водород с окончанием -ная и слово кислота. Например: HF – фтороводородная кислота, H2S – сероводородная кислота, HCN – циановодородная кислота. Названия кислородсодержащих кислот зависят от степени окисления кислотообразующего элемента. Максимальной степени окисления соответствует суффикс -н или -ов (HNO3 – азотная кислота, H2CrO4 – хромовая кислота). По мере понижения степени окисления суффиксы изменяются в следующей последовательности: -новат, -ист, -новатист (НСlO3 – хлорноватая, HClO2 – хлористая, HСlO – хлорноватистая). Если элемент образует кислоты только в 2-х степенях окисления, то для названия кислоты, соответствующей низшей степени окисления элемента, используется суффикс -ист (HNO2 – азотистая). Если элемент, находясь в одной и той же степени окисления, образует несколько кислот, то название кислоты, содержащее наименьшее количество атомов кислорода снабжается приставкой мета, а название кислоты с наибольшим числом атомов кислорода – приставкой орто (HРO3 – метафосфорная кислота, Н3РО4 – ортофосфорная кислота). Если молекула кислоты содержит два атома кислотообразующего элемента, то перед ее названием помещается числительная приставка дву–, ди– или пиро– (Н4Р2О7 – двуфосфорная, дифосфорная или пирофосфорная кислота). Кислоты, содержащие в своем составе группировку атомов –О–О– можно рассматривать как производные пероксида водорода – пероксокислоты (или надкислоты). Например, H2SO5 – пероксосерная кислота, HNO3 – пероксоазотная кислота. Порядок соединения атомов в молекуле отображают графические формулы: Н3РО4 Н2SO4
|

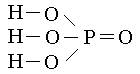
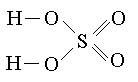
 Физические свойства. Большинство кислот – это бесцветные прозрачные жидкости, которые смешиваются с водой в любых соотношениях. Бывают также твердые кислоты (H3PO3, H3BO3, HIO3) растворимые в воде. Нерастворимой в воде является кремниевая кислота (H2SiO3). Некоторые кислоты являются растворами газов в воде (HCl, H2S). Растворы кислот кислые на вкус.
Физические свойства. Большинство кислот – это бесцветные прозрачные жидкости, которые смешиваются с водой в любых соотношениях. Бывают также твердые кислоты (H3PO3, H3BO3, HIO3) растворимые в воде. Нерастворимой в воде является кремниевая кислота (H2SiO3). Некоторые кислоты являются растворами газов в воде (HCl, H2S). Растворы кислот кислые на вкус.


