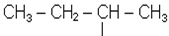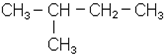Лабораторна робота 4
НАСИЧЕНІ ВУГЛЕВОДНІ
Будова, ізомерія, номенклатура, властивості
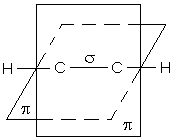
Вуглеводнями називають сполуки, які складаються з атомів вуглецю та водню. Вуглеводні діляться на насичені та ненасичені. Насичені вуглеводні (алкани, парафіни) мають тільки прості (одинарні) зв’язки між атомами вуглецю, ненасичені мають і кратні зв’язки - подвійні та потрійні. Будь-який простий зв’язок між атомами вуглецю й іншими (у тому числі атомом вуглецю) називається s-зв’язком: для нього характерне перекриття електронних орбіталей уздовж лінії, яка з’єднує центри атомів. що взаємодіють. В утворенні s-зв’язку з боку атома вуглецю завжди бере участь гібридна sp-, sp2- або sp3-орбіталь. Один із кратних зв’язків вуглецевого атома в різних сполуках є s-зв’язком. Інші зв’язки, утворені не гібридними, а р-орбіталями, називаються p-зв’язками. Вони утворюються за рахунок перекривання р-орбіталей по обидва боки лінії, яка з’єднує центри атомів: вони менш міцні, ніж s-зв’язки і більш рухомі.
p-зв’язок в етилені розташований в площині, перпендикулярній площині роз-ташування s-зв’язків. В ацетилені є два p-зв’язки, які знаходяться в двох взаємно перпендикулярних площинах.
Спільна формула насичених вуглеводнів - СnH2n+2. Алкани мають суфікс -ан, а радикали -ил (іл).
Гомологічний ряд
Ізомерія насичених вуглеводнів залежить від структури вуглецевого скелета (ізомерія ланцюга, або ізомерія скелета). Бутан - найпростіший представник наси-чених вуглеводнів, який може існувати у вигляді ізомерів:
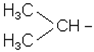
Ізомерія алкільних радикалів починається з радикала С3Н7-:
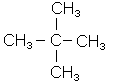
Радикали С4Н9- можуть існувати у вигляді 4-х ізомерів
Назва втор-бутил пов’язана з тим, що цей радикал має вільну валентність у вуглецевого атома, що з’єднується з двома сусідніми атомами вуглецю. В радикалах бутил і ізобутил вільна валентність в обох випадках знаходиться біля первинного вуг-лецевого атома (пов’язаного з одним сусіднім атомом вуглецю). Тоді радикал, який має нерозгалужений ланцюг, називається нормальний бутил, а розгалужений - ізо-бутил. Прийнято префікс “ізо” приєднувати до назви радикалів, у яких дві метильні групи знаходяться на кінці нерозгалуженого ланцюга:
ізопентил Для назви вуглеводнів з розгалуженим ланцюгом використовуються дві номен-клатури. Одна умовно називається раціональною (РН), за основу беруть найпрості-ший вуглеводень - метан: називають в порядку ускладнення радикали, які розташо-вані біля атома вуглецю, прийнятого за залишок метану, потім додають слово “метан”. Більш новою і досконалою є друга номенклатура, що називається міжнарод-ною, або IUPAC. Згідно з нею за основу береться назва алкану, що відповідає найдовшому в молекулі ланцюгу вуглецевих атомів (не враховуючи розгалужень). Ланцюг нумерують з того кінця, до якого ближче розгалуження: вказують цифрами положення радикалів, потім їх назву і завершують назвою вуглеводню, взятого за основу:
Дослід 4.1. Синтез метану та вивчення його властивостей
В суху пробірку 1, обладнану пробкою з газовідвідною трубкою (рис. 4.1), кладуть суміш зневодненого оцтовокислого натрію і натронного вапна (приблизно 1:2, висота шару 6-10 мм). Натронне вапно (суміш їдкого натру і оксиду кальцію) беруть тому, що чистий їдкий натр роз’їдає скло при нагріванні. Крім того, натронне вапно не плавиться при нагріванні і завдяки його пористості полегшується виділення метану. Хімізм процесу: СН3СООNa + NaOH ® CH4 + Nа2CO3 Підпалюють метан, який виходить з кінця газовідвідної трубки, він горить голубуватим несвітним полум’ям.
Рис. 4.1. Синтез метану з оцтовокислого натрію Хімізм процесу: СН4 + 2О2 ® СО2 + 2Н2О Таким чином, при нагріванні натрієвої солі оцтової кислоти з натронним вапном сіль розщеплюється з утворенням метану. Нагрівання натрієвих солей карбонових кислот з натронним вапном є загальним лабораторним способом отримання на-сичених вуглеводнів.
Реакція метану на бромну воду і перманганат калію В суху пробірку вміщують 5 крапель розчину перманганату калію (або бромної води). Не припиняючи нагрівання суміші в пробірці 1, вводять кінець газовідводної трубки в пробірку 2 з перманганатом (або бромною водою). Знебарвлювання розчинів перманганату калію й бромної води не відбувається. В звичайних умовах алкани стійкі до дії окислювачів. Реакції заміщення у них відбуваються в жорстких умовах, а до реакції приєднання алкани не здатні. Дослід 4.2. Бромування насичених вуглеводнів
Увага! Дослід проводити у витяжній шафі. У суху пробірку вміщують 4 краплі суміші рідких алканів і додають 1-2 краплі розчину брому. Суміш перемішують на холоді. Забарвлення брому при цьому не зникає. Потім пробірку нагрівають до зникнення забарвлення. В отвір пробірки вносять скляну паличку, змочену розчином аміаку, - з’являється білий димок NH4Br. Пінцетом вносять у пробірку змочений водою лакмусовий папірець - він червоніє.
Хімізм процесу:
2-бром-2-метилбутан Бромування рідких алканів супроводжувається виділенням бромистого водню і відбувається значно повільніше, ніж газоподібних алканів. Реакція прискорюється при використанні каталізаторів: залізних ошурок, кристалічного йоду. Найлегше галогенуються вуглеводні з третинним атомом вуглецю в молекулі, найважче заміщуються атоми водню при первинному атомі вуглецю. Енергія s-зв’язку водню з первинним атомом вуглецю дорівнює 99 ккал/моль; вторинним - 94 ккал/моль (389 кДж/моль); третинним - 90 ккал/моль (376,8 кДж/моль). Різниця в швидкості реакції галогенування особливо виявляється при дії брому. Окислення парафінів Насичені вуглеводні (парафіни) дуже стійкі до дії таких сильних окислювачів, як перманганат калію і хромова суміш. Окислюються в газовій фазі, утворюючи суміш нижчих спиртів, альдегідів, кетонів і кислот. Цей метод використовується для отри-мання формальдегіду. При температурі вище 300°С насичені вуглеводні горять з утворенням СО2 і Н2О: С5Н12 + 8О2 ® 5СО2 +6Н2О При більш високих температурах у промисловості відбувається процес взаємо-дії метану з водою: СН4 +Н2О ® СО + 3Н2
Дослід 4.3. Окислення алканів
У пробірку відбирають одну краплю алкану або суміші алканів, одну краплю вуглекислого натрію і дві-три краплі розчину перманганату калію. Суміш енергійно перемішують, фіолетовий колір водного шару не змінюється, бо алкани в цих умовах не окисляються. Контрольні запитання 1. Напишіть структурні формули вуглеводнів: а) 2,5-диметилгексан; б) 3-метил-3-етилпентан; в) 2-метил-4-ізопропілгептан; г) 3-етилундекан; д) 2,4-диметил-4-етил-октан. 2. Напишіть структурні формули ізомерних вуглеводнів складу С6Н14. Назвіть їх. Вкажіть ізомери з третинними атомами вуглецю. 3. Які вуглеводні утворюються при дії металічного натрію на суміш: а) йодистого метилу і йодистого ізобутилу; б) йодистого етилу і йодистого ізопропілу; в) йо-дистого пропілу і бромистого ізоамілу? 4. Напишіть структурну формулу органічної речовини складу С5Н12, якщо відомо, що при її хлоруванні утворюється переважно третинне хлорпохідне, а при нітруванні - третинна нітросполука. Поясніть, чому заміщення найлегше відбувається у тре-тинного атома вуглецю. 5. Напишить схеми отримання ізобутану (будь-яким способом) і його нітрування. 6. Перетворіть бромистий ізобутил у насичений вуглеводень: з тією ж будовою ву-глецевого скелета; з подвійним числом вуглецевих атомів.
|