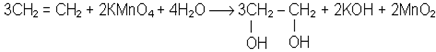Лабораторна робота 5
АЛКЕНИ Будова, ізомерія, номенклатура, властивості
Вуглеводні з подвійним зв’язком називаються етиленовими (олефінами, ал-кенами). Вони мають загальну формулу СnН2n. За міжнародною номенклатурою назву алкена утворюють таким чином: вибирають найдовший ланцюг вуглецевих атомів з подвійним зв’язком і закінчення алканів “-ан” замінюють на “-ен”. Рахунок вуглецевих атомів починають з кінця, ближнього до подвійного зв’язку. Називають розгалуження, вказуючи цифрами їх розташування, потім основний ланцюг із закінченням “-ен“ і вказують цифрою місце, де починається подвійний зв’язок:
Молекули з двома подвійними зв’язками належать до класу алкадієнів, які називають, додаючи перед закінченням частку “ді-”:
бутадієн - 1,3
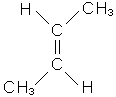
Дуже часто алкени називають без урахування розгалуження (за винятком бути-лену), використовуючи закінчення “-илен”: С2Н4-етилен, С3Н6-пропілен, С4Н8-бутилен та ізобутилен (розгалужений вуглеводень), С5Н10-амілен або пентілен - так можна назвати будь-який з ізомерів С5Н10. У всіх ненасичених вуглеводнів існує два види ізомерії: ланцюга і розта-шування кратного зв’язку. Крім того, етиленові вуглеводні, які мають різноманітні (щонайменше два) радикали біля атомів вуглецю, зв’язаних подвійним зв’язком, можуть існувати у вигляді просторових ізомерів залежно від розташування радикалів щодо подвійного зв’язку. Цей вид ізомерії називається цис-транс-ізомерією, або геометричною. У цис-ізомера однакові радикали розташовані по один бік від площини подвійного зв’язку, у транс-ізомера - по різні.
Для ненасичених вуглеводнів характерні реакції приєднання (головним чином, електрофільного), окислення і полімеризації. У алкенів спостерігається в ІЧ-спектрах характерне поглинання при 3100, 1420 і 915 см-1 (=С-Н) і 1650 см-1 (валентні коливання -С=С-, коли подвійний зв’язок роз-міщується на кінці ланцюга).
Дослід 5.1. Отримання етилену і його горіння
В суху пробірку поміщають декілька крупинок піску, 6 крапель етилового спирту і 8 крапель концентрованої сірчаної кислоти. Закривають пробірку пробкою з газо-відвідною трубкою і обережно нагрівають суміш на полум’ї пальника. Газ, який виді-ляється, підпалюють на кінці газовідвідної трубки - він горить світним полум’ям. Хімізм процесу: СН3 - СН2ОН + HOSO3H етилсірчана кислота Етилсірчана кислота - моноефір неорганічної двоосновної кислоти - при нагрі-ванні розкладається: СН3 - СН2 - OSO3H ® CH2 = CH2 + H2SO4 Таким чином, при взаємодії етилового спирту з сірчаною кислотою відбу-вається дегідратація спирту: СН3 - СН2 - ОН ® СН2 = СН2 + Н2О Етилен, що виділяється, горить світним полум’ям: С2Н4 + 3О2 ® СО2 + 2Н2О Концентрована сірчана кислота - окислювач. При нагріванні суміші спирту з концентрованою сірчаною кислотою утворюється, крім етилену і слідів діетилового ефіру (С2Н5)2О, ряд продуктів окислення органічних сполук, наприклад, СО2, вугілля С (суміш у пробірці чорніє). Сірчана кислота при цьому відновлюється вуглецем до діоксиду сірки: 2Н2SO4 + C ® CO2 + 2SO2 + 2H2O Діоксид сірки також може знебарвити розчини брому і перманганату калію подібно етилену. Тому звичайно отриманий етилен промивають розчином лугу для очищення від SO2. Якщо реакцію здійснювати в присутності піску, сульфату алюмінію (каталізаторів, які прискорюють дегідратацію спирту), то суміш не чорніє, отже, ді-оксид сірки не утворюється. Дегiдратацiя спиртiв є загальним способом отримання ненасичених вуглеводнiв.
Дослiд 5.2. Приєднання до етилену брому
Не припиняючи нагрiвання пробiрки, в якiй знаходиться сумiш спирту i сiрчаної кислоти, опускають кiнець газовiдвiдної трубки в пробiрку з п’ятьма краплями бромної води. Бромна вода швидко знебарвлюється внаслiдок приєднання атомiв брому на мiсцi подвiйного зв’язку. Хiмiзм процесу:
Для алкенiв ця реакцiя служить якiсною реакцiєю на подвiйний зв’язок. Дослiд 5.3. Взаємодiя з окислювачами
Не припиняючи нагрiвання пробiрки, в якiй знаходиться сумiш спирту i сiрчаної кислоти, опускають кiнець газовiдвiдної трубки в пробiрку з однiєю краплею розчину перманганату калiю i чотирма краплями води. Розчин перманганату калiю швидко знебарвлюється. При цьому алкен окислюється до двухатомного спирту.
Хiмiзм процесу:
Ця реакцiя також є якiсною на подвiйний зв’язок. Контрольнi запитання 1. Напишiть структурнi формули таких вуглеводнів: а) 5-метилгептен-3; б) 4,4-ди-метилпентен-2; в) 2,3,3-триметилпентен-1; г) 2,4-диметилпентен-1. Назвiть їх. 2. Напишіть структурні формули ізомерних ациклічних вуглеводнів складу С6Н12. Назвіть їх. 3. На прикладi пояснiть правило Зайцева. 4. Отримайте 4-метилпентен-2 iз 4-метилпентену-1. 4-метилпентен-2 окислiть кон-центрованим розчином KMnO4. 5. Отримайте будь-яким способом 2-метилбутен-1. Напишiть для нього рiвняння реакцii з KMnO4. 6. Якi вуглеводнi отримують при дiї цинку на дигалогенпохiднi: 2,3-дибромпентан; 2,3-дибром-2-метилпентан? 7. Напишіть реакції приєднання: а) НВr до пропену; б) НСl до 2,2-диметилпентену-3.
|

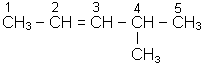


 CH3 - CH2 - OSO3H + H2O
CH3 - CH2 - OSO3H + H2O