Середня кінетична енергія молекул. Внутрішня енергія ідеального газу
Найменше число незалежних величин, які визначають положення системи у просторі, називається числом ступенів вільності системи. Наприклад, матеріальна точка має три ступені вільності, бо досить трьох координат x, y, z, щоб задати її положення. Система з N незалежних (або нежорстко зв’язаних) матеріальних точок має 3 N ступенів вільності. Система з двох жорстко зв’язаних точок має п’ять ступенів вільності. Всякий жорсткий зв’язок, що закріплює відстань між двома точками, зменшує число ступенів вільності на одиницю. Тому система з трьох і більше жорстко зв’язаних матеріальних точок з нелінійним розміщенням має шість ступенів вільності. Три з них відповідають поступальному руху центра мас і ще три – обертальному руху системи навколо трьох взаємно перпендикулярних осей. Молекулу в першому наближенні можна розглядати як систему з жорстко зв’язаних матеріальних точок-атомів. При цьому число ступенів вільності для одноатомних молекул і =3, для двохатомних – і =5, для трьох і більше атомних – і =6. У класичній статистичній фізиці Больцманом доведена теорема, що називається законом рівномірного розподілу кінетичної енергії молекул за ступенями вільності. Формулювання цього закону: на кожний ступінь вільності молекули в середньому припадає однакова кінетична енергія, рівна 1/2 kТ. Це означає, що молекула, яка характеризується числом ступенів вільності “ і ”, має середню кінетичну енергію
Наприклад, для одноатомної молекули ця величина рівна 3/2 kT, що співпадає з середньою кінетичною енергією поступального руху (див. формулу (2.14)). Займемося тепер розрахунком внутрішньої енергії ідеального газу. Молекули ідеального газу не взаємодіють між собою, тому для такої системи внутрішня енергія співпадає з сумарною кінетичною енергією молекул. Внутрішня енергія одного моля ідеального газу
|

 . (2.31)
. (2.31) . Якщо врахувати тепер вираз (2.31) та означення сталої Больцмана (2.5), то одержуємо
. Якщо врахувати тепер вираз (2.31) та означення сталої Больцмана (2.5), то одержуємо 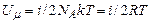 . Внутрішня енергія довільної кількості ідеального газу
. Внутрішня енергія довільної кількості ідеального газу  . Остаточно
. Остаточно . (2.32)
. (2.32)


