Ізотерми Ван-дер-Ваальса. Метастабільні стани. Критична точка
Рівняння (2.64) є кубічним відносно об’єму. Воно має три корені і на діаграмі p–V при сталій температурі зображається кривою 3-го порядку, що називається ізотермою Ван-дер-Ваальса (див. рис.2.20а). Горизонталь p *=const на рис. проводиться так, щоб заштриховані площі були однакові (це можна одержати на основі 2-го начала термодинаміки).
Якщо рухатися у зворотному напрямку, тобто ізотермічно розширювати рідину, то в т. с почнеться кипіння. У т. b рідини вже не буде, вся випарувалася при кипінні на ділянці с-b. Таким чином, ділянка a-b відповідає станам газу, b-c – суміші рідини та газу, c-d – рідини. Порівнюючи теоретичну ізотерму з експериментальною (криві а) та б)), бачимо, що теоретична ділянка cefb на досліді спостерігається у вигляді горизонтального відрізка cb прямої. Правда, ділянки ce та bf можна за спеціальних умов спостерігати. Перша з них відповідає станам перегрітої рідини (коли в посудині немає домішок і гладенькі стінки, то затримується кипіння), а друга – станам перенасиченої (переохолодженої) пари (теж коли немає центрів конденсації). При низьких температурах т.е може попасти в область “від’ємних” тисків; такий стан (стани) відомий під назвою “розтягнутої” рідини. Стани ділянок ce та bf називаються метастабільними (проміжні між стабільними і нестабільними станами). Стани ділянки ef нестабільні (нестійкі) і на досліді не спостерігаються.
Справа від “ковпака” (допоміжної параболи) на рис. маємо стани, що відповідають газу; під “ковпаком” – стани двофазної системи “рідина+газ”; зліва – стани рідини. Значення критичних параметрів можна виразити через поправки Ван-дер-Ваальса а та b:
для цього треба підставити у рівняння (2.64) замість р та Т критичний тиск
|

 Типовий експеримент по ізотермічному стисканню газу (напр.,
Типовий експеримент по ізотермічному стисканню газу (напр., 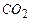 при кімнатній температурі) дає криву, що на рис.2.20б. Зменшення об’єму до
при кімнатній температурі) дає криву, що на рис.2.20б. Зменшення об’єму до 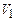 при сталій температурі викликає збільшення тиску (ділянка а-b). Дальше зменшення об’єму не змінює тиску, але починаючи з т. b йде інтенсивна конденсація газу, тобто перетворення газу в рідину. Цей процес продовжується до т.с, що відповідає об’єму
при сталій температурі викликає збільшення тиску (ділянка а-b). Дальше зменшення об’єму не змінює тиску, але починаючи з т. b йде інтенсивна конденсація газу, тобто перетворення газу в рідину. Цей процес продовжується до т.с, що відповідає об’єму 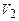 . При досягненні об’єму
. При досягненні об’єму  Якщо побудувати ізотерми, що відповідають різним температурам, то одержимо картину, що на рис.2.21 (експериментальні криві). Із збільшенням температури ділянка конденсації (кипіння) скорочується і при
Якщо побудувати ізотерми, що відповідають різним температурам, то одержимо картину, що на рис.2.21 (експериментальні криві). Із збільшенням температури ділянка конденсації (кипіння) скорочується і при 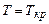 стягується в т.К. Для
стягується в т.К. Для 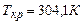 та
та 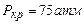 (1атм – нормальний тиск). Точка К відповідає критичному стану речовини, в якому зникає різниця між рідиною та газом, рівні нулю питома теплота пароутворення і поверхневий натяг. При температурі, вищій від
(1атм – нормальний тиск). Точка К відповідає критичному стану речовини, в якому зникає різниця між рідиною та газом, рівні нулю питома теплота пароутворення і поверхневий натяг. При температурі, вищій від 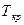 , ніяким стисканням газ в рідину перетворити не можна, тому критичною температурою називають граничну температуру, при якій закінчується можливість перетворення газу в рідину.
, ніяким стисканням газ в рідину перетворити не можна, тому критичною температурою називають граничну температуру, при якій закінчується можливість перетворення газу в рідину. ,
, 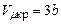 ,
, 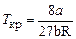 ;
;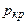 та критичну температуру
та критичну температуру 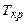 , замість нуля у правій частині рівняння записати для критичного стану
, замість нуля у правій частині рівняння записати для критичного стану 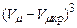 і прирівняти в одержаному співвідношенні коефіцієнти при однакових степенях
і прирівняти в одержаному співвідношенні коефіцієнти при однакових степенях 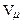 .
.


