Фази і фазові перетворення. Умови рівноваги фаз. Потрійна точка
Фаза – це термодинамічно рівноважний стан речовини, що фізично відрізняється від інших рівноважних станів цієї речовини. Наприклад, розглядаючи ізотерми реальних газів, справа і зверху відносно “ковпака” ми мали справу зі станами однофазної системи – газу; під “ковпаком” – область станів двофазної системи рідина+газ; зліва – знову стани однофазної системи – рідини. Можуть бути двофазні системи тверде тіло+рідина, тверде тіло+газ. Різними фазами є також різні модифікації однієї речовини, наприклад, алмаз і графіт є різними твердими фазами вуглецю, лід зустрічається у п’яти різних фазах. Фазова рівновага – це одночасне існування термодинамічно рівноважних фаз у багатофазній системі (рідина + насичена пара, вода + лід при температурі плавлення, нормальна + надпровідна фази металу в зовнішньому магнітному полі і т. д.). При певних умовах різні фази однієї речовини можуть бути в рівновазі між собою; рівновага двох фаз можлива лише в певній області температур і тисків. На діаграмі р-Т стани рівноваги двофазної системи зображаються кривою Перехід речовини з однієї фази в іншу називається фазовим переходом. Якщо при цьому поглинається чи виділяється теплота, то кажуть, що спостерігається фазовий перехід І-го роду. Фазові переходи, не зв’язані з поглинанням чи виділенням тепла, називаються фазовими переходами ІІ-го роду. Спочатку охарактеризуємо коротко фазові переходи І-го роду. Перехід речовини з рідкого стану в газоподібний називається випаровуванням, з твердого стану в газоподібний – сублімацією, з газоподібного в рідкий – конденсацією, з твердого в рідкий – плавленням, з рідкого у твердий кристалічний – кристалізацією. При випаровуванні чи сублімації тіло залишають молекули, що мають достатньо великий запас кінетичної енергії для перемагання сил притягання між молекулами. Тому тіло охолоджується. Кількість теплоти, необхідна для переведення одиниці маси речовини з рідкого стану в газоподібний при тій же температурі, називається питомою теплотою пароутворення:
Якщо у процесі випаровування кількість молекул, які покинули рідину, рівна кількості молекул, що конденсувалися, то кажуть, що між рідиною та її парою наступила динамічна рівновага. Пара, що знаходиться в рівновазі зі своєю рідиною, називається насиченою. Насичена пара при даній температурі має максимальну густину і тиск. Із збільшенням температури тиск насиченої пари зростає,
У зв’язку з цим температура кипіння зростає із збільшенням тиску, бо при кипінні тиск насиченої пари рівний зовнішньому тиску. Тверді кристалічні тіла плавляться при постійній температурі. Теплота, що підводиться ззовні, йде на розривання зв’язків між атомами (іонами). Кількість теплоти, необхідна для плавлення одиниці маси речовини, називається питомою теплотою плавлення:
Температура плавлення залежить від тиску. Для більшості речовин температура плавлення збільшується з ростом тиску, тобто Процес кристалізації – зворотний до процесу плавлення. Для кристалізації необхідно охолодити рідину до температури плавлення (до стану (р, Т), що відповідає рівновазі між твердою і рідкою фазою). При кристалізації виділяється та ж кількість теплоти, що була затрачена на плавлення. Якщо фазові переходи І-го роду характеризуються постійністю температури, змінами ентропії та об’єму, то фазові переходи ІІ-го роду – постійністю об’єму та ентропії, але стрибкоподібною зміною теплоємності. Прикладами фазових переходів ІІ-го роду є: перехід феромагнетиків (заліза, нікелю) при певних тиску і температурі в парамагнітний стан; перехід металів і деяких сплавів у надпровідний стан без зовнішнього магнітного поля; перетворення звичайного рідкого гелію (гелію-І) в іншу модифікацію (гелій–ІІ), що володіє надтекучістю. Фазові переходи ІІ-го роду зв’язані зі зміною симетрії: вище точки переходу система володіє, як правило, більшим рівнем симетрії, ніж нижче точки переходу.
|

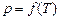 , яка і задає умови рівноваги фаз. Три фази однієї речовини можуть бути в рівновазі лише в одному стані, при одних значеннях Т і р, яким на діаграмі р-Т відповідає потрійна точка. Рівновага більше від трьох фаз однієї речовини неможлива.
, яка і задає умови рівноваги фаз. Три фази однієї речовини можуть бути в рівновазі лише в одному стані, при одних значеннях Т і р, яким на діаграмі р-Т відповідає потрійна точка. Рівновага більше від трьох фаз однієї речовини неможлива.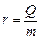 , (2.69)
, (2.69) При конденсації та ж кількість теплоти виділяється, рідина нагрівається.
При конденсації та ж кількість теплоти виділяється, рідина нагрівається. .
. .
.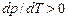 , а для льоду, чавуну, вісмуту і сурми – навпаки.
, а для льоду, чавуну, вісмуту і сурми – навпаки.


