Фазові діаграми
В т. П, де сходяться криві випаровування і сублімації, у рівновазі знаходяться три фази речовини: тверда, рідка і газоподібна. Цій єдиній точці відповідає температура Температура у потрійній точці є одночасно температурою, при якій плавиться речовина при тиску
Для речовин з декількома кристалічними модифікаціями діаграма стану складніша. На рис.2.29 зображена діаграма у випадку двох різних модифікацій. Тепер є дві потрійні точки. У точці Діаграма стану будується для кожної речовини на основі експериментальних даних. Маючи її, можна завжди вказати, в якому стані знаходиться речовина при тих чи інших умовах, які перетворення супроводитимуть речовину при різних процесах, як Якщо, наприклад, взяти речовину у стані 1 на рис.2.30 і піддати її ізобаричному нагріванню, то речовина буде проходити зображену пунктирною прямою 1-2 послідовність станів, що відповідають кристалу, рідині, газу. Якщо цю ж речовину взяти у стані 3 і ізобарично нагрівати, то послідовність станів буде інша (пунктирна пряма 3-4): кристал безпосередньо перетворюється в газ, минаючи рідку фазу. Якщо питомий об’єм кристалу більший від питомого об’єму рідини, то поведінка речовини при деяких процесах може бути своєрідною. Візьмемо, наприклад, таку речовину у стані 5 на рис.2.30 і піддамо її ізотермічному стисканню. Тиск збільшується; процес зобразиться на діаграмі пунктирною прямою 5-6. Речовина проходить таку послідовність станів: газ – кристал – рідина. Така послідовність може спостерігатися лише при температурах, менших від температури З діаграми стану випливає, що рідка фаза може існувати в рівноважному стані лише при тисках, які задовільняють умову У більшості речовин потрійній точці відповідає тиск Відмітимо ще одну особливість діаграми стану. Крива випаровування закінчується у критичній точці К. Тому можливий перехід з області рідких станів в область газоподібних, обходячи критичну точку без перетину кривої випаровування (див. зображений пунктиром перехід 7-8 на рис.2.30). В цьому випадку перехід рідина®газ (і навпаки) виконується неперервно, через послідовність однофазних станів. Такий перехід можливий тому, що різниця між рідиною і газом має швидше кількісний, ніж якісний характер; зокрема, в обох цих станах відсутня анізотропія. Перехід же зі стану, для котрого характерна анізотропія, у стан, що не володіє нею, може відбуватися лише стрибком (анізотропія або є, або нема). Так само неможливий неперервний перехід з однієї кристалічної модифікації в іншу. Різні кристалічні модифікації речовини відрізняються притаманними їм елементами симетрії. Оскільки якийсь елемент симетрії або є, або відсутній, то перехід з однієї твердої фази в другу можливий лише стрибком. Тому крива рівноваги двох твердих фаз, як і крива плавлення, не обмежена (йде в безмежність).
|

 Візьмемо речовину у критичному стані (т. К на рис.2.28) і будемо повільно її охолоджувати (відбирати тепло) без зміни об’єму, так щоб рідина була в рівновазі з парою. При цьому, очевидно, буде знижуватися тиск і двофазна система рідина+газ (пара) проходитиме ряд рівноважних станів, що зображаються кривою КП. Цю криву називають кривою випаровування (залежність тиску насиченої пари від температури). Вона закінчується при деякій температурі
Візьмемо речовину у критичному стані (т. К на рис.2.28) і будемо повільно її охолоджувати (відбирати тепло) без зміни об’єму, так щоб рідина була в рівновазі з парою. При цьому, очевидно, буде знижуватися тиск і двофазна система рідина+газ (пара) проходитиме ряд рівноважних станів, що зображаються кривою КП. Цю криву називають кривою випаровування (залежність тиску насиченої пари від температури). Вона закінчується при деякій температурі 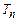 , рівній температурі кристалізації речовини при даному тиску. Охолоджуємо далі речовину, а температура її не змінюється, бо йде процес кристалізації і ми якраз забираємо від речовини тепло, що виділяється при кристалізації. Закінчився процес кристалізації і дальше охолодження системи приведе до наступного зниження температури вже твердого тіла. Відповідна крива, що тягнеться до початку координат, відображає рівноважні стани двофазної системи тверде тіло+газ. Вона називається кривою сублімації.
, рівній температурі кристалізації речовини при даному тиску. Охолоджуємо далі речовину, а температура її не змінюється, бо йде процес кристалізації і ми якраз забираємо від речовини тепло, що виділяється при кристалізації. Закінчився процес кристалізації і дальше охолодження системи приведе до наступного зниження температури вже твердого тіла. Відповідна крива, що тягнеться до початку координат, відображає рівноважні стани двофазної системи тверде тіло+газ. Вона називається кривою сублімації.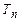 і тиск
і тиск 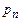 . Це – потрійна точка. Вона визначає умову
. Це – потрійна точка. Вона визначає умову 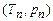 , при якій одночасно можуть знаходитись у рівновазі три фази речовини.
, при якій одночасно можуть знаходитись у рівновазі три фази речовини. інша!). Крива, що зображає зв’язок між тиском і температурою плавлення, називається кривою плавлення. Для більшості речовин ця крива нахилена до кривої випаровування
інша!). Крива, що зображає зв’язок між тиском і температурою плавлення, називається кривою плавлення. Для більшості речовин ця крива нахилена до кривої випаровування 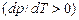 , як на рис. 2.28; для окремих речовин її нахил інший (як на рис.2.30). Кривизна кривої плавлення незначна.
, як на рис. 2.28; для окремих речовин її нахил інший (як на рис.2.30). Кривизна кривої плавлення незначна. Криві випаровування, сублімації та плавлення задають умови рівноваги двофазних систем. Рівноважні стани на тих кривих відрізняються лише співвідношеннями мас речовини у різних фазах, відповідно. Ці криві розбивають площину р-Т на три області. Зліва знаходяться рівноважні стани твердої фази речовини, справа – газоподібної, зверху – рідкої. Т.ч. кожна точка діаграми (всієї площини) зображає певний рівноважний стан речовини, що відповідає одній, двом чи трьом фазам. Тому її називають діаграмою стану або фазовою діаграмою.
Криві випаровування, сублімації та плавлення задають умови рівноваги двофазних систем. Рівноважні стани на тих кривих відрізняються лише співвідношеннями мас речовини у різних фазах, відповідно. Ці криві розбивають площину р-Т на три області. Зліва знаходяться рівноважні стани твердої фази речовини, справа – газоподібної, зверху – рідкої. Т.ч. кожна точка діаграми (всієї площини) зображає певний рівноважний стан речовини, що відповідає одній, двом чи трьом фазам. Тому її називають діаграмою стану або фазовою діаграмою.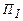 в рівновазі знаходяться рідина, газ і перша кристалічна модифікація, в точці
в рівновазі знаходяться рідина, газ і перша кристалічна модифікація, в точці 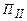 – рідина і обидві кристалічні модифікації речовини.
– рідина і обидві кристалічні модифікації речовини. перевести речовину з одного стану в другий.
перевести речовину з одного стану в другий.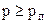 . Те саме стосується і твердої фази ІІ, що на рис. 2.29. При тисках, менших від
. Те саме стосується і твердої фази ІІ, що на рис. 2.29. При тисках, менших від 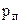 спостерігаються лише переохолоджені рідини.
спостерігаються лише переохолоджені рідини.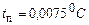 і
і 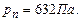 Для вуглекислоти
Для вуглекислоти 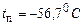 , а
, а 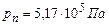 , тому вуглекислота за звичайних умов швидко сублімує, минаючи рідкий стан. Це – так званий сухий лід; він не плавиться, а лише випаровується.
, тому вуглекислота за звичайних умов швидко сублімує, минаючи рідкий стан. Це – так званий сухий лід; він не плавиться, а лише випаровується.


