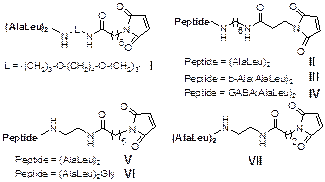КОНСТРУИРОВАНИЕ И СИНТЕЗ ПОЛИФУНКЦИОНАЛЬНЫХ ЛИНКЕРНЫХ ГРУПП НА ОСНОВЕ ПЕПТИДОВ – СУБСТРАТОВ ЦИСТЕИНОВЫХ КАТЕПСИНОВ
Яринич Л.А. Новосибирский государственный университет, Институт химической биологии и фундаментальной медицины СО РАН, Новосибирск, Россия. Аспирант 1г. yarinich-1@yandex.ru Научный руководитель: Сильников В. Н.
В настоящее время активно ведутся работы по исследованию транспортных систем для адресной доставки терапевтических олигонуклеотидов в клетки-мишени. В направлении, основанном на применении противоопухолевых препаратов в онкологии, требуется повысить избирательность и эффективность их действия. В качестве молекулярного вектора для доставки препаратов в опухолевые клетки можно использовать человеческий сывороточный альбумин. После проникновения терапевтической конструкции в клетки-мишени требуется отсоединение антисмыслового нуклеотида от белка-транспортера. Эту задачу можно решить путем использования пептидного мостика, который является субстратом для катепсинов, принимающих участие в раковой прогрессии, для сшивания белка с олигонуклеотидом. Целью настоящей работы является синтез пептидных бифункциональных мостиков – субстратов цистеиновых протеаз – для получения на их основе конъюгатов белка-транспортера с антисмысловым олигонуклеотидом или лекарственным препаратом. Синтез Ala-Leu-содержащих пептидов проводили в растворе методом активированных эфиров с использованием Boc‑стратегии. На их основе были синтезированы различные бифункциональные реагенты. Для повышения нуклеофильности концевой аминогруппы пептида были получены бифункциональные реагенты на основе b-Ala(AlaLeu)2 и GABA(AlaLeu)2 (соединения I – VII).
Все вышеперечисленные бифункциональные реагенты содержат малеимидный остаток и аминогруппу. Также нами было получено бифункциональное соединение, содержащее малеимидную и карбоксильную функции (соединение VIII).
Свободная аминогруппа обеспечивает возможность присоединения по N -концу пептида антисмыслового олигонуклеотида или лекарственного препарата. Наличие малеимидного остатка в структуре синтезированного пептидо-олигонуклеотидного конъюгата позволяет осуществить сшивку с транспортным белком крови. При помощи конфокальной микроскопии возможно изучение механизма транспорта флуоресцентно меченых конструкций в клетке, а также проверка субстратных свойств используемых пептидов. Для исследования поведения белковых конъюгатов в культурах клеток нами было синтезировано флуоресцентное производное на основе бифункционального реагента VI и N,N,N’,N’‑тетраметил-5‑карбоксиродамина. При взаимодействии полученного флуоресцентно меченого биодеградируемого пептида с человеческим сывороточным альбумином нами был получен белковый конъюгат IX через образование сульфидной связи между сульфгидрильной группой остатка цистеина в белке и малеимидным остатком реагента.
Строение полученных соединений было подтверждено методами ЯМР спектроскопии и масс-спектрометрии.
Работа выполнена при поддержке фонда «Современное естествознание» (образовательный грант № P12-061).
|