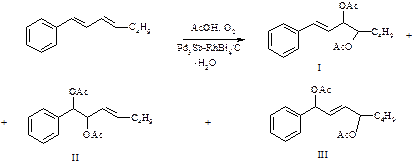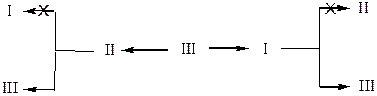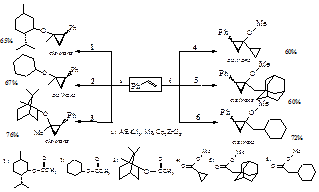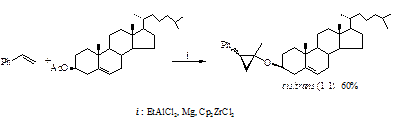МЕХАНИЗМ КАТАЛИТИЧЕСКОЙ ИЗОМЕРИЗАЦИИ ДИАЦЕТОКСИПРОИЗВОДНЫХ 1-ФЕНИЛ-1(2)-ОКТЕНОВ
Гриша А.С. Всероссийский научно-исследовательский институт нефтехимических процессов, Санкт-Петербург, Россия. Аспирант 3г. gertsog5000@yandex.ru Научный руководитель: де Векки Андрей Васильевич
Особенностью реакций окислительного кросс-сочетания является возможность их проведения в условиях, чрезвычайно близких к условиям реакции ацетоксилирования. Последняя, в свою очередь, позволяет функционализировать образующиеся продукты сочетания, что при проведении синтеза однореакторно представляет несомненный интерес как для органической химии вообще, так и для химической технологии, в частности. Практический интерес обусловлен тем, что диацетоксипроизводные определенных структур являются синтонами для получения супрамолекулярных объектов, способных выступать в качестве молекулярных переключателей, работающих по принципу челнока, а также для синтеза дендримерных структур – нового типа высокомолекулярных соединений, перспективы использования которых в фармакокинетике и OLED-технологиях трудно переоценить. На примере реакции кросс-сочетания стирола и 1-гексена в условиях реакции ацетоксилирования нами показано [1], что происходит образование 1,2-, 3,4- и 1,4-диацетоксипроизводных 1-фенил-1(2)-фенилоктенов, а также их геометрических изомеров.
Указанные изомеры подвергаются последующей взаимной изомеризации в присутствии катализаторов Pd3Sb и RhBi4 или их смеси при температуре 100 оС и давлении воздуха 8 МПа [2]. Нами выявлено, что механизм позиционной изомеризации реализуется в так называемом кондукторном режиме, по которому внутрисферная миграция ацетоксигруппы осуществляется через координационный центр.
Полученные данные в неравновесных условиях реакции смеси геометрических изомеров соединений (I) и (II) показывают, что миграция 1,2 и 3,4-диацетоксигрупп протекает только через скелетный изомер (III), т.е. через 1,4-диацетоксипроизводное 1-фенилоктена.
Результаты оценки кинетических и термодинамических параметров реакции позволяют считать, что в изучаемом процессе изомеризация контролируется как термодинамическими, так и кинетическими факторами, что предопределяет пути для увеличения селективности образования целевых 1,2-диацетопроизводных.
Литература: [1] Гриша А.С., де Векки А.В. Ж. прикл. хим. 11, 1817–1822 (2011). [2] Гриша А.С., де Векки А.В. Ж. прикл. хим. 9, 1510–1516 (2011). ЦИКЛОПРОПАНИРОВАНИЕ ВИНИЛАРЕНОВ С ПОМОЩЬЮ EtAlCl2 И RCO2R’ ПОД ДЕЙСТВИЕМ КАТАЛИЗАТОРА Cp2ZrCl2
Губайдуллин Р.Р.,1 Лукша Р.С.2 1 Институт нефтехимии и катализа РАН, Уфа, Россия. Молодой учёный. Rinatg83@mail.ru 2 Башкирский государственной педагогический университет им. М. Акмуллы, Уфа, Россия. Студент V курса. Научный руководитель: Хафизова Л.О.
Недавно [1], нами разработан эффективный метод циклопропанирования виниларенов взаимодействием последних с алкилгалогеналанами и простейшими эфирами алифатических карбоновых кислот в присутствии катализатора Cp2ZrCl2 с получением арилзамещенных алкоксициклопропанов. В развитии этих работ с целью изучения влияния структуры исходных эфиров на выход и стереохимию образования замещенных циклопропанов мы вовлекли в реакцию со стиролом и EtAlCl2 в присутствии катализатора Cp2ZrCl2 ряд циклоалкановых эфиров алкилкарбоновых кислот (ментилацетат, циклогексилацетат, борнилацетат), а также алкиловых эфиров циклоалкилкарбоновых кислот (метиловый эфир адамантан-, циклогексануксусной кислоты и метиловый эфир циклопропанкарбоновой кислоты).
Установлено, что независимо от структуры исходных сложных эфиров в каждом опыте образуется стереоизомерная смесь (цис / транс) алкокси(циклоалкокси)циклопропанов с выходами 60-76 %. С целью выяснения влияния объемного полициклического заместителя в эфирном субстрате на выход и стереохимию продуктов циклопропанирования в реакцию со стиролом и EtAlCl2 в присутствии катализатора Cp2ZrCl2 мы вовлекли ацетатат холестерина.
Полученные результаты позволили сделать вывод, что даже такие объемные заместители в молекуле исходного сложного эфира мало влияют как на выход целевого замещенного циклопропана, так и стереохимию образующихся в этой реакции 1-метил-1-холестерил-2-фенилциклопропанов. Таким образом, эфиры карбоновых кислот, содержащие в своей структуре циклические и полициклические заместители, достаточно гладко реагируют с виниларенами и EtAlCl2 в присутствии катализатора Cp2ZrCl2 с образованием соответствующих стереоизомерных замещенных циклопропанов. Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект 11-03-97008-р_поволжье_а). Литература: [1] Khafizova L. O., Gubaidullin R. R., Dzhemilev U. M. Tetrahedron. 67, 9142- 9147, (2011)
|