Дослід 2. Солі, утворені сильними основами та слабкими кислотами.
а) За допомогою універсального індикаторного паперу визначте рН 0,1Н розчину ацетату натрію. Напишіть іонно–молекулярні рівняння реакції гідролізу та обчисліть Кг. Кд(CH3COOH) = =1,75*10–5. Зробіть висновок про здатність аніонів слабкої кислоти до гідролізу. Рівняння гідролізу:____________________________________________________________________ ____________________________________________________________________________________ ____________________________________________________________________________________
Висновок:________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ б) Налийте в одну пробірку 5–6 крапель 0,5Н розчину карбонату натрію, а в другу пробірку — такий же об’єм 0,5Н розчину сульфіту натрію. Додайте в кожну пробірку по краплі фенолфталеїну і порівняйте забарвлення розчинів. Напишіть іонно–молекулярні рівняння реакцій гідролізу. Обчисліть ступінь, константу гідролізу, концентрацію гідроксид–іонів та рН розчинів солей. Одержані результати запишіть у таблицю. (
Рівняння гідролізу:____________________________________________________________________ ____________________________________________________________________________________ ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Висновок:________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ в) У дві пробірки додайте: у першу 5–6 крапель 0,1Н розчину гідрокарбонату натрію та краплю фенолфталеїну, у другу — такий же об’єм 0,1Н розчину гідросульфіту натрію та краплю фенолфталеїну. Відмітьте забарвлення розчинів. Напишіть іонно–молекулярні рівняння реакцій гідролізу. Обчисліть константи гідролізу солей, порівняйте їх із значеннями Кд2 відповідних кислот. Обчисліть рН розчинів солей. Заповніть таблицю (див. еталони). ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
|


 (H2CO3) = 4,7*10–11;
(H2CO3) = 4,7*10–11; 
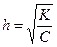 =
[OH–] =
=
[OH–] =






