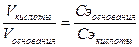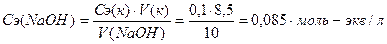Теоретическая часть. Метод нейтрализации широко применяется в медико-биологических исследованиях, при проведении клинических анализов (например
Метод нейтрализации широко применяется в медико-биологических исследованиях, при проведении клинических анализов (например, определение кислотности мочи, желудочного сока и др. биологических жидкостей), в санитарно-гигиеническом контроле воды, пищевых продуктов (молока, хлеба), лекарств. Метод нейтрализации позволяет по результатам титрования определить точную концентрацию компонента кислотного или основного характера в исследуемом растворе и вычислить его содержание в граммах. В основе метода лежит реакция нейтрализации между кислотой и основанием, кислотой и основной солью, основанием и кислой солью, т.е. реакция взаимодействия гидратированных ионов Н+ и ОН- Н+ + ОН- = Н2О Теоретической основой метода является закон эквивалентов: Массы реагирующих веществ прямо пропорциональны молярным массам эквивалентов:
Следствие из закона эквивалентов: Объемы реагирующих веществ обратно пропорциональны молярным концентрациям их эквивалентов:
Процесс определения концентрации неизвестного вещества основан на титровании – добавлении небольших порций одного из растворов к заранее известному объему другого раствора. Раствор с веществом неизвестной концентрации называется анализируемым, а раствор, содержащий реагент, концентрация которого известна с большой точностью, называется рабочим раствором. В процессе титрования наступает момент, когда количества реагирующих веществ в смеси становятся эквивалентными (точка эквивалентности). Для определения точки эквивалентности в реакции нейтрализации используют кислотно-основные индикаторы. Это сложные органические вещества со слабыми кислотными или основными свойствами. Окраска этих соединений в молекулярной и ионизированной формах различается (см. таблицу).
Обучающая задача: Вычислить содержание (масса, г) гидроксида натрия в 250 мл раствора и титр рабочего раствора гидроксида натрия, если на титрование 10 мл этого раствора было израсходовано 8, 5 мл щавелевой кислоты (Н2С2О4·2 Н2О) с Сэ = 0, 1 моль-экв/л Решение: 1. Напишем уравнение реакции: 2NaOH + Н2С2О4 = Na2С2О4 + 2H2O 2. Определим фактор эквивалентности и молярную массу эквивалента NaOH: f экв (NaOH) = 1; Мэ (NaOH) = 40 г-экв/моль 3. Определим Сэ раствора NaOH, используя следствие из закона эквивалентов:
4. Определим титр раствора:
5. Определим массу NaOH в 250 мл раствора: m = V·Т = 250·0, 003400 = 0, 85 г Ответ: m (NaOH) в 250 мл раствора = 0, 85 г Задачи для самостоятельного решения 1. При определении кислотности молока на титрование 100 мл его пошло 25 мл раствора едкого натра с Сэ =0, 01 моль/л. Определить Сэ молочной кислоты в молоке. Ответ: Сэ = 0.0025 моль-экв/л 2. Сколько граммов хлороводорода содержится в 100 мл желудочного сока, если на титрование 15 мл этого раствора расходуется 30 мл раствора КОН с Сэ = 0.1 моль/л? Ответ: m (HCl) = 0, 73 г 3. 1, 5 г технического КОН растворено в колбе на 250 мл. На титрование 5 мл этого раствора пошло 4, 5 мл раствора соляной кислоты с Сэ = 0, 1 моль/л (К=0.8). Определить массовую долю КОН в навеске. Ответ: С% = 67, 2% 4. Сколько граммов буры Na2B4O7 содержится в 250 мл, если 10 мл этого раствора оттитровываются 12, 3 мл раствора соляной кислоты с Т=0.003650г/мл? Ответ: m(буры) = 5, 864 г Тестовые задания к разделу 2 1 К методу нейтрализации не относится взаимодействие а) HNO3 + NaOH = NaNO3 + H2O б) BaCl2 + 2AgNO3 = 2 AgCl + Ba(NO3)2 в) KHCO3 + ROH = K2CO3 + H2O г) CuOHCl + HCl = H2O + CuCl2 2. Титриметрический анализ основан на законе _________________ 3. Масса КОН (г), которая требуется для приготовления 1 л 0, 1 М раствора, составляет а) 5, 6 б) 1, 7 в) 2, 8 г) 56 4. Титриметрический анализ используют для определения а) концентрации вещества в растворе б) ионного состава раствора в) объема раствора г) вещества в растворе
|