Реактив К. Фишера, метод П. Мартена и дихроматно-иодометрический метод
С помощью реактива Карла Фишера можно точно и быстро определить воду в органических и неорганических соединениях. В основе метода лежит взаимодействие иода с водой. Реактив Фишера представляет собой смешанный раствор оксида серы SO2, иода и пиридина в метиловом спирте. Реактив выпускается заводами в виде комплекта, состоящего из двух бутылок: в одной содержится раствор сернистого ангидрида в пиридине, во второй – раствор иода в метиловом спирте. Для приготовления реактива с титром около 1 г H2O/ см3 смешивают 100 см3 раствора из первой бутылки и 217 см3 – из второй. Затем туда добавляют осушенный метиловый спирт (683 см3). Содержимое перемешивают. Оставляют стоять не менее суток, затем используют для титрования. Взаимодействие этого реактива с водой протекает в две стадии по стехиометрическим уравнениям: Первая стадия: I2 + SO2 + 3C5H5N + H2O → 2 C5H5N·HI + C5H5NSO3 (2) Вторая стадия: C5H5NSO3 + CH3OH → C5H5N·HSO4CH3 (3) Для титрования используют специальные колбы и бюретки, которые сообщаются с атмосферой через хлоркальциевые трубки. Применяемые растворители (метанол и пиридин) – дорогие, дефицитные, ядовитые и летучие. Работа требует осторожности. На рис. 6.1, 6.2 и 6.3 показано специальное аппаратурное оформление для титрования с реактивом Фишера: схемы установок для визуального титрования (рис.6.1) и для амперометрического титрования (рис.6.2) и колбы (рис.6.3).
Методика определения воды с помощью реактива Фишера: Точную навеску исследуемого вещества, содержащего 0, 03-0, 05 г воды помещают в сухую колбу на 100 см3, в которую внесено 5 см3 метилового спирта. Перемешивают 1 минуту и титруют реактивом Фишера, добавляя его по каплям. Конец титрования определяют визуально по изменению окраски от жёлтой до красновато- коричневой. Параллельно титруют 5 см3 метилового спирта (контрольный опыт). Содержание воды в % вычисляют по формуле: X = где: а – объём реактива Фишера, израсходованный на титрование в основном опыте, см3; б – объём реактива Фишера, израсходованный на титрование в контрольном опыте в г, см3; в – навеска препарата, в г; Т – титр реактива Фишера (титр должен быть Установка титра: 0, 04 г воды вносят в сухую колбу вместимостью 100 см3, содержащую 5 см3 метилового спирта и титруют реактивом Фишера, прибавляя его в конце титрования по 0, 1 – 0, 05 см3. Параллельно титруют 5 см3 метилового спирта. Титр в г/ см3 реактива Фишера вычисляют по формуле: W = где а – навеска воды (г), б – объём реактива Фишера в см3 в основном титровании, в – объём реактива Фишера в см3 в контрольном опыте.
Сущность метода Пьера Мартена заключается в окислении спирта дихроматом калия в кислой среде в уксусную кислоту и в титровании образовавшегося избытка дихромата калия раствором соли Мора в кислой среде: K2Cr2O7 + 6 FeSO4 · (NH4)2SO4 + 7 H2SO4 → K2SO4 + Cr2(SO4)3 + 3 Fe2(SO4)3 + 6 (NH4)2SO4 + 7 H2O. (4) Для определения конца реакции применяется индикатор гексациано-(Ι Ι Ι)-феррат калия (красная кровяная соль), который при взаимодействии с солью Мора образует характерное соединение интенсивного синего цвета, так называемую турнбулеву синь: 3FeSO4· (NH4)2SO4 + 2K3Fe(CN)6 → Fe3[Fe(CN)6]2 + 3 K2SO4 + 3 (NH4)2SO4. (5) Наиболее точные результаты метод даёт при содержании спирта в жидкости в пределах 1-2%. Поэтому при больших концентрациях спирта прибегают к разбавлению продукта, а при малых производят разбавление (в 10 раз) растворов дихромата калия и соли Мора. Погрешность метода обычно не превышает 1% от определяемой величины, но присутствие в дистилляте, помимо этилового спирта, других веществ, окисляющихся дихроматом калия, даёт завышенные результаты.
|



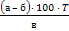 , (6.10)
, (6.10) 0, 004 г/ см3).
0, 004 г/ см3). , (6.11)
, (6.11)


