ТЕМА 3 АЛКЕНЫ
Алкенами называют непредельные углеводороды, содержащие двойную связь. Первым членом гомологического ряда алкенов является этилен, поэтому иногда алкены называют этиленовыми углеводородами. Часто их называют олефинами. Общая формула гомологического ряда — СnH2n. Свойства непредельных углеводородов более многообразны, чем предельных. Непредельные углеводороды в отличие от предельных (насыщенных) характеризуются высокой реакционной способностью. Это объясняется энергетической непрочностью π -связи и ее пространственной доступностью для атаки извне. Под действием атакующего реагента в определенных условиях π -связь разрывается, у двух соседних атомов, между которыми разорвалась π -связь, освобождаются валентности. По месту разрыва связей происходит реакция присоединения, в результате чего молекула становится насыщенной. Таким образом, основным типом реакций, характерным для непредельных углеводородов, являются реакции присоединения, а не замещения. Для алкенов характерны также реакции окисления и полимеризации. 1. Гидрирование. Взаимодействие водорода с алкенами протекает в присутствии катализаторов (Pt, Ni): kat СН2 = СН2 + Н2 → СН3 – СН3.
2. Галогенирование. Присоединение галогенов, особенно хлора и брома, очень легко протекает при обычных условиях. В результате реакции образуется дигалогенопроизводное предельного углеводо-рода: СН2 = СН2 + Br2 → СН2Br – СН2Br 1, 2 - дибромэтан.
Эта реакция является качественной реакцией на наличие в органических соединениях двойной связи, т. к. бромная вода при этом обесцвечивается, указывая на протекание реакции присоединения галоида. 3. Присоединение галогеноводородов. Реакция присоединения галогеноводородов к алкенам протекает согласно правилу В. В. Марковникова: при соединении галогеноводородов к непредельным соединениям водород присоединяется к более гидрогенизированному атому углерода, а галоген – к менее гидрогенизированному атому углерода:
CH3 – CH = CH2 + HCl → CH3 – CHCl – CH3 2 - хлорпропан.
4. Гидратация. Реакция присоединения воды к алкенам проходит также в соответствии с правилом В. В. Марковникова. Катализатором реакции служит концентрированная серная кислота или фосфорная кислота. H2SO4 СН2=СН2 + НОН → СН3–СН2–ОН этиловый спирт; СН3–СН=СН2 + НОН → СН3–СНОН–СН3 изопропиловый спирт.
5. Окисление. По своей способности к окислению алкены сильно отличаются от алканов. При окислении алкенов в присутствии серебряного катализатора образуются окиси:
О окись этилена Русский химик Е. Е. Вагнер установил, что окисление алкенов в водной среде (растворами перманганата калия или перекиси водорода) приводит к образованию гликолей:
СН2=СН2 + [О] + Н2О → СН2ОН – СН2ОН; этиленгликоль 3CH2 = CH2 + 2KMnO4 + 4H2O → 3CH2OH – CH2OH + 2MnO2+2KOH. Более энергичное окисление алкенов сопровождается расщеп-лением молекулы по месту разрыва двойной связи с образованием карбоновых кислот:
СН3–СН=СН2 + [О] → СН3 – СООН + СО2 + Н2О; СН3–СН=СН– СН3+ [О] → 2СН3 – СООН.
В очень жестких условиях окисления алкены сгорают с образованием СО2 и Н2О: СН2=СН2 + 3О2 → 2СО2 + 2Н2О.
6. Полимеризация. Молекулы алкенов могут соединяться между собой, причем число таких присоединений может быть разным и образующийся продукт реакции может иметь очень большую молекулярную массу. Такие соединения получили название полимеров:
nCH2 = CH2 → –CH2–CH2–CH2–CH2–…– CH2–CH2– или [–CH2–CH2–]n полиэтилен
В данном разделе рассмотрены основные химические свойства алкенов: гидрирование, галогенирование, гидратация, присоединение галогеноводородов, окисление, полимеризация. [ 3, с. 29− 34; 5, с. 59− 76; 6, с. 408− 414].
|


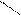 2СН2 = СН2 + О2 → 2СН2 – СН2 .
2СН2 = СН2 + О2 → 2СН2 – СН2 .


