Опыт № 1. Окисляемость ароматических углеводородов
1.1. В пробирку с 5 каплями воды внести 1 каплю раствора КМnО4. К полученному раствору добавить 2–3 капли бензола и толуола, встряхнуть. 1.2. В пробирку поместить несколько капель раствора КМnО4 и каплю 2 н раствора Н2SО4, добавить несколько капель ксилола или толуола, энергично встряхивая, нагревать над пламенем спиртовки. Задания: 1. Описать, какие изменения наблюдаете при взаимо-действии бензола, толуола, ксилола с перманганатом калия в водном растворе и в присутствии серной кислоты. 2. Написать уравнения реакций. Уравнять. Опыт № 2. Бромирование бензола (тяга) В две пробирки наливают по 1 мл бензола и по 1 мл раствора брома в тетрахлориде углерода. В одну из пробирок добавляют немного железных опилок (на кончике шпателя). Пробирки закрывают пробками с воздушными холодильниками и нагревают на теплой водяной бане. Через некоторое время в пробирке с железными опилками происходит обесцвечивание реакционной смеси. Синяя лакмусовая бумажка, смоченная водой и поднесенная к свободным концам стеклянных трубок, подтверждает, что реакция идет только в пробирке с железными опилками (происходит изменение цвета индикатора от паров выделяющегося бромоводорода):
бензол бромбензол
Через 5–10 мин после начала реакции в реакционную смесь опускают полоску фильтровальной бумаги, которую затем подсушивают на воздухе. На бумаге остается бромбензол, отличающийся по запаху от исходного бензола. Необходимо помнить, что реакция замещения водорода в бензоле происходит в присутствии активированной частицы галогена. Активирование галогена осуществляется действием катализаторов (часто кислоты Льюиса). Галогенирование в ядро протекает по механизму замещения (SЕ). Задания: 1.Написать уравнение реакции образования апротонной кислоты Льюиса (FеВr3) и механизм реакции бромирования бензола. 2. Указать, какие из изомеров дибромбензола могут получиться при дальнейшем бромировании бромбензола. Почему? Написать уравнения реакции.
|



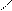
 + Br2 + HBr.
+ Br2 + HBr.


