IV. Реакции окисления спиртов
Реакции окисления спиртов протекают по-разному в зависимости от того, какой спирт – первичный, вторичный или третичный – подвергается окислению. 6. Окисление спиртов обычно производят довольно сильными окислителями, например, бихроматом калия K2Cr2O7 или перманга-натом калия KMnO4 в кислой среде (обычно в присутствии H2SO4) а) при окислении первичных спиртов образуются альдегиды – вещества, для которых характерно наличие альдегидной группы. При этой реакции вначале окисляется атом водорода, связанный с тем же атомом углерода, что и гидроксил; полученный двухатомный спирт, у которого оба гидроксила стоят у одного и того же атома углерода, непрочен: он разлагается с выделением воды и образованием альдегидной группы:
OH OH O
б) при окислении вторичных спиртов образуются кетоны. Возможен и другой механизм окисления, доказанный при проведении реакции в отсутствие кислорода – при наличии веществ, способных отнимать водород (например, метиленовая синь или мелко раздробленный палладий). Тогда реакция окисления или, точнее, дегидрирования, будет протекать по другой схеме:
Многоатомные спирты содержат две и более спиртовые гидроксильные группы. Многоатомные спирты отличает от одноатомных их способность растворять гидроокиси тяжелых металлов. Например, характерно растворение Сu(OH)2 с появлением синего окрашивания:
глицерин глицерат меди (II)
Такое отличие многоатомных спиртов от одноатомных можно объяснить накоплением гидроксильных групп в молекулах многоатомных спиртов, что придает им более кислые свойства. В образовавшемся соединении атом меди связан с двумя молекулами диола двумя основными и двумя дополнительными валентностями. Подобные соединения, в которых образуются циклы за счет дополнительных валентностей, связывающих внутри молекулы отде-льные ее атомы, называются хелатами. Наибольшее количество глицерина идет на приготовление тринитрата глицерина – эфира азотной кислоты, который чаще неправильно называют нитроглицерин. Для получения тринитрата на глицерин действует смесью HNO3 и H2SO4:
H H
Тринитрат глицерина представляет собой тяжелую (пл.1, 601 г/см3 при 5 °С) маслянистую жидкость сладкого вкуса. Он не растворим в воде, но легко растворяется в органических растворителях. Простыми эфирами называются продукты замещения атома водорода в гидроксиле спирта радикалом:
R – O – H → R – O – R.
Простые эфиры, в отличие от спиртов, из которых они получаются, а также от сложных эфиров, представляют собой весьма стойкие в химическом отношении вещества. В отличие от сложных эфиров вода их не гидролизует; не действуют на них и едкие щелочи. Большинство кислот также практически не действуют на простые эфиры. Исключение составляют лишь концентрированные серная и иодистоводородная кислоты, которые разлагают простые эфиры. 1. Концентрированная серная кислота, поглощая пары простых эфиров, превращает их в соответствующие сложные эфиры и спирты, например:
этисерная этиловый кислота спирт 2. Концентрированная иодистоводородная кислота уже на холоде разлагает эфиры с образованием галогеналкила и спирта, например:
C2H5 – O – C2H5 + HI → C2H5I + C2H5OH.
При нагревании реакция протекает с образованием двух молекул галогеналкила, например:
R – O – R' + 2HI → RI + R'I + H2O.
Благодаря легкости протекания реакции с HI ею часто пользуются для количественного определения алкоксигрупп – OR (метоксильных групп – ОСН3 и этоксильных групп – ОС2Н5). 3. Окисление. Будучи крайне стойкими к гидролитическому расщеплению, простые эфиры способны окисляться. Одним из продуктов окисления простых эфиров являются органические перекисные соединения. Таким образом, в данном разделе разработаны характерные реакции для спиртов и простых эфиров. Указаны отличия в их реакциооной способности. [ 1, с. 58− 62; 3, с. 70− 94; 5, с. 114− 144; 6, с. 429− 437, 442].
|



 H H
H H



 R – C – H + O → R – C – OH → R – C – H + H2O.
R – C – H + O → R – C – OH → R – C – H + H2O.

 R–C– H + метиленовая синь → R–C– H + восстановленная метилено-
R–C– H + метиленовая синь → R–C– H + восстановленная метилено- ОН О вая синь
ОН О вая синь

 H
H


 H2C – OH H2C – O O CH
H2C – OH H2C – O O CH




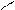 Cu
Cu
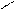

 HC OH + Cu(OH)2 → HC O O CH + 2H2O
HC OH + Cu(OH)2 → HC O O CH + 2H2O

 H
H
 H2C – OH H2C – OH HO CH2
H2C – OH H2C – OH HO CH2
 H H
H H
 HC – OH HO – NO2 Н2SO4 HC – O – NO2
HC – OH HO – NO2 Н2SO4 HC – O – NO2 HC – OH + HO – NO2 → HC – O – NO2 + 3Н2О
HC – OH + HO – NO2 → HC – O – NO2 + 3Н2О

 C2H5O C2H5 + HOSO3H → C2H5OSO3H + C2H5OH.
C2H5O C2H5 + HOSO3H → C2H5OSO3H + C2H5OH.


