АЛЬДЕГИДЫ И КЕТОНЫ
атомом водорода, так что получается одновалентный радикал – С, Н называемый альдегидной группой. В кетонах карбонильная группа
соединена с двумя углеводородными радикалами C = О. R Эта группа называется кетогруппой. Разбирая химические свойства альдегидов и кетонов, необходимо подчеркнуть их большую химическую активность, которая обусловлена в основном наличием карбонильной группы. Карбонильная группа содержит двойную связь, которая по физической природе сходна с двойной углеродной связью. Однако, в отличие от двойной связи между атомами углерода, вследствие большей электроотрицательности атома кислорода по сравнению с атомом углерода, двойная связь в карбонильной группе поляризуется и у атома углерода возникает повышенная электронная плотность: δ + δ -
Реакционная способность альдегидов и кетонов определяется характером связей в карбонильной группе: 1) наличие π -связей – реак-
ция присоединения; 2) полярность связи С = О – реакция замещения кислорода. 1. Восстановление. Взаимодействие водорода с альдегидами и кетонами приводит к образованию первичных и вторичных спиртов соответственно:
H альдегид первичный спирт
R – CO – R + H2 → R – CHOH – R. кетон вторичный спирт 2. Образование оксинитрилов. При взаимодействии альдегидов или кетонов с синильной кислотой образуются оксинитрилы (циангидрины):
H OH
OH CN 3. Образование бисульфитных производных. При присоединении к альдегидам или кетонам водных растворов бисульфита натрия образуются плохо растворимые кристаллические вещества – бисульфитные соединения альдегидов или кетонов:
H OH
Эта реакция имеет практическое значение для очистки альдегидов или кетонов от примесей, т. к. выпадающие в осадок (бисульфитные производные легко отделяются, очищаются и переводятся в исходные альдегид или кетон:
OH H 4. Образование полуацеталей. Альдегиды реагирует со спиртами, образуя полуацетали – неполные эфиры двухатомных спиртов, содержащих обе гидроксильные группы при одном атоме углерода. Если полученный полуацеталь нагреть с избыточным количеством спирта, то образуется ацеталь – полный эфир:
H OR' OR' полуацеталь ацеталь
Для кетонов образование аналогичных соединений – кеталей – по этой реакции не характерно. Кетали образуются более сложным путем. 5. Присоединение магнийорганических соединений (реактивов Гриньяра). В результате этой реакции образуются первичные, вторичные и третичные спирты. Остановимся на общей схеме этой реакции:
карбонильное реактив спирт соединение Гриньяра
Альдегиды и кетоны вступают в реакции с аммиаком и большим числом веществ, содержащих в молекуле NH2 группы. На первой стадии реакции образуются продукты присоединения, являющиеся очень нестойкими соединениями. В результате происходит отщепления молекулы воды и образование продуктов реакции, которые удобнее рассматривать как производные замещения атома кислорода в молекуле альдегида или кетона.
7. Замедление карбонильного кислорода галоидом. При взаимодействии альдегидов или кетонов с галоидными соединениями фосфора происходит замещение атома кислорода карбонильной группы молекулы кетона или альдегида двумя атомами галогена:
H
R–CO–R + PCl5 → R–CCl2–R + POCl3.
Взаимодействие альдегидов или кетонов непосредственно с галогеном (хлор, бром, йод) приводит к образованию продукта замещения атомов водорода в углеводородном радикале:
H -HCl H -2HCl H ацетальдегид хлоруксусный хлораль альдегид
CH3 –CO –CH3 +Cl2 → CH2Cl – CO – CH3. ацетон -HCl хлорацетон 8. Окисление альдегидов и кетонов. Альдегиды чрезвычайно легко окисляются. В результате образуются соответствующие карбоновые кислоты:
H OH
Кетоны окисляются лишь в жестких условиях, причем из-за отсутствия атома водорода в карбонильной группе происходит расщепление молекулы кетона на две части, окисление которых приводит к образованию карбоновых кислот.
CH3 – CO – CH3 + O2 → HCOOH + CH3COOH ацетон муравьиная уксусная кислота кислота
При окислении несимметричных кетонов соблюдаются правила Попова-Вагнера, согласно которым расщепление кетонов происходит так, что карбонильная группа остается с меньшим углеводородным радикалом:
CH3 – CO – CH2 – CH3 + O2 → 2CH3COOH. метилэтилкетон уксусная кислота
9. Образование гидразонов и фенилгидразонов. Реакция альдегидов или кетонов с гидразином или его производным-фенилгидразином дает продукты замещения – гидразоны или фенидгидразоны соответственно:
10. Реакция Канниццаро. Для альдегидов, не имеющих в молекуле α -водородных атомов, возможно протекание реакции окисления-восстановления, т. к. одна молекула такого альдегида окисляется до соответствующей карбоновой кислоты за счет того, что другая молекула альдегида восстанавливается до соответствующего спирта. Реакция Канниццаро проводится в присутствии щелочи.
CH3 H CH3 H КОНЦ CH3 ONa CH3 триметилуксусный Na-соль третичный альдегид триметилуксусной бутиловый кислоты спирт 11. Реакции конденсации. Молекулы альдегидов могут реагировать друг с другом, образуя соединение с новой углерод–угле-родной связью. Такие реакции альдегидов получили название реакций конденсации. Альдольная конденсация. При взаимодействии молекул альдегидов, содержащих по соседству с карбонильной группой атомы водорода, друг с другом образуются альдолы – соединения, содержащие альдегидную и спиртовую функциональные группы.
При нагревании альдолов отщепляется молекула воды, и образуются непредельные альдегиды. Впервые такую реакцию конденсации при нагревании провели с уксусным альдегидом, получив кротоновый альдегид, и поэтому эту реакцию назвали кротоновой конденсацией, хотя она и представляет собой реакцию альдольной конденсации, проведенную при нагревании:
H H H кротоновый альдегид Сложноэфирная конденсация. Альдегиды в определенных условиях могут реагировать друг с другом с образованием сложных эфиров. Впервые эту реакцию осуществил Тищенко, и поэтому часто эту реакцию называют конденсацией по Тищенко:
Бензоиновая конденсация. Ароматические альдегиды при катализе с цианистым калием способны образовывать бензоины, что на при-мере бензальдегида еще в 1839 году показал Н. Н. Зинин:
Полимеризация альдегидов. Реакция полимеризации альдегидов происходит за счет разрыва π -связи в карбонильной группе и присоединения молекул друг к другу с образованием новой связи между атомами кислорода одной молекулы и углерода другой молекулы. Количество присоединившихся молекул невелико.
формальдегид CH2
H CH3-CH CH-CH3
Итак, в разделе были рассмотрены химические свойства альдегидов и кетонов. Отмечена большая химическая активность карбонильных соединений. [ 1, с. 63− 70; 3, с. 128− 139; 5, с. 147− 167; 6, с. 451− 467].
|

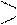 Альдегиды и кетоны характеризуются присутствием в молекуле карбонильной группы С=О. В альдегидах атом углерода связан с
Альдегиды и кетоны характеризуются присутствием в молекуле карбонильной группы С=О. В альдегидах атом углерода связан с О
О R
R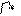
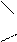 С = О.
С = О.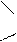 +δ -δ
+δ -δ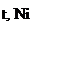
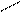
 О
О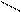 R – C + H2 → R – CH2 – OH;
R – C + H2 → R – CH2 – OH;

 O
O
 R – C + HCN → R – CH – CN оксинитрил;
R – C + HCN → R – CH – CN оксинитрил;
 R – CO – R + HCN→ R – C– R оксинитрил.
R – CO – R + HCN→ R – C– R оксинитрил.
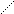 O
O

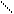 R – CH – SO3Na + NaHCO3 → R – C + Na2SO3 + CO2 + H2O.
R – CH – SO3Na + NaHCO3 → R – C + Na2SO3 + CO2 + H2O.
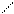 O OH R'–OH OR'
O OH R'–OH OR'


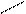 Cδ + = Oδ - + R+– Mg-– J → R–C–OMgJ → R–C–OH + Mg(OH)J.
Cδ + = Oδ - + R+– Mg-– J → R–C–OMgJ → R–C–OH + Mg(OH)J. 6. Образование оксимов. В результате взаимодействия альдегидов или кетонов с гидроксиламином образуются альдоксимы и кетоксимы:
6. Образование оксимов. В результате взаимодействия альдегидов или кетонов с гидроксиламином образуются альдоксимы и кетоксимы:

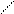

 R – C + N H2 – OH → H2O + R – CH = N – OH;
R – C + N H2 – OH → H2O + R – CH = N – OH; H альдоксим
H альдоксим


 R–C–R + N H2 – OH → H2O + R – C – R.
R–C–R + N H2 – OH → H2O + R – C – R.






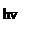 O O 2Cl2 O
O O 2Cl2 O




 O
O R–C–R + N H2 – NH–C6H5 → H2O + R – C – R.
R–C–R + N H2 – NH–C6H5 → H2O + R – C – R. фенилгидразон фенилгидразон кетона
фенилгидразон фенилгидразон кетона


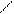


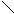 CH3–C–C + CH3–C–C → CH3–C–C + CH3–C–CH2OH.
CH3–C–C + CH3–C–C → CH3–C–C + CH3–C–CH2OH.
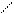
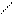

 O O OH O
O O OH O
 CH3 – C +CH3 – C → CH3–CH–CH2–C.
CH3 – C +CH3 – C → CH3–CH–CH2–C. H H альдоль H
H H альдоль H

 CH3–C + CH3–C → H2O + CH3–CH=CH–C.
CH3–C + CH3–C → H2O + CH3–CH=CH–C.
 CH3–C + CH3– C CH3–C – O–CH2–CH3.
CH3–C + CH3– C CH3–C – O–CH2–CH3. H H этилацетат
H H этилацетат

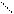
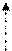


 H H OH O бензоин
H H OH O бензоин

 О
О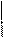
 О СН2 СН2
О СН2 СН2 3HC
3HC 
 СH3
СH3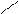
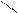 CH
CH
 O O O
O O O

 3CH3 – С
3CH3 – С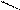
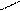 ацетальдегид O
ацетальдегид O


