ТЕМА 22 АМИНОКИСЛОТЫ
Аминокислоты – это соединения со смешанными функциями. С одной стороны это кислоты, т. к. содержат карбоксильную группу, с другой стороны – это основания, т. к. содержат аминогруппу. Так как в молекуле аминокислоты находятся одновременно основная и кислотная группы, то они взаимодействуют между собой, образуя внутреннюю соль – бетаин:
H2N OН H3N+ O-
Этим объясняются высокие температуры плавления аминокислот и способность их растворов проводить электрический ток. При подкислении раствора аминокислота реагирует как основание, образуя соли за счет аминогруппы. При подщелачивании раствора она реагирует как кислота, образуя соли соответствующих металлов за счет карбоксильной группы:
Химические свойства аминокислот: 1. Образование сложных эфиров: Аминокислоты могут образовывать сложные эфиры со спиртами:
О 2. Образование хлористоводородных солей:
NH2CH2COOH + HCl → HCl ∙ NH2CH2COOH или [NH3CH2COOH]Cl- 3. Образование металлических солей: NH2CH2COOH + Cu(OH)2 → комплексное соединение синего цвета следующего строения:
4. Действие азотистой кислоты:
NH2 OH
5. Отличительная реакция α -, β - и γ -кислот. При нагревании α -аминокислот идет отщепление воды и замыкание цикла дипептида с образованием дикетопиперазина:
-H2O -H2O, t
СН2
β -аминокислоты при нагревании отщепляют аммиак с образованием α -, β -непредельных кислот:
СН2 – СН2 γ -аминокислоты образуют лактамы. Таким образом, в данном разделе представлены основные химические свойства аминокислот. [ 1, с. 93− 94; 4, с. 45− 50; 5, с. 315− 327; 6, с. 528− 550].
|






 R – CH – C = O R – CH – C = O.
R – CH – C = O R – CH – C = O. R +OH- R +[H+] R
R +OH- R +[H+] R



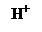





 CH3 – CHNH2COO H + HO C2H5 → CH3 – CHNH2 – COOC2H5 + H2O.
CH3 – CHNH2COO H + HO C2H5 → CH3 – CHNH2 – COOC2H5 + H2O.



 R – CH – NH2 H2N – CH – R
R – CH – NH2 H2N – CH – R
 COO Cu ОCO
COO Cu ОCO
 CH3CH – COOH + HO – N = O → N2 +H2O + CH3 – CH – COOH.
CH3CH – COOH + HO – N = O → N2 +H2O + CH3 – CH – COOH. NH2CH2COOH + NH2CH2СООН
NH2CH2COOH + NH2CH2СООН  NH2 CH2CONHCH2COOH
NH2 CH2CONHCH2COOH
 CH2
CH2
 NH CO.
NH CO.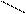
 CO NH
CO NH

 Н2NСН2СН2СООН СН2=СНСООН;
Н2NСН2СН2СООН СН2=СНСООН; СО – СН2
СО – СН2

 Н2NСН2СН2СН2СООН NН.
Н2NСН2СН2СН2СООН NН.


