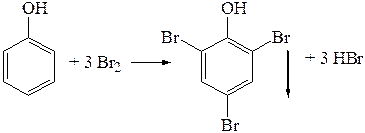Качественный анализ.
Фенол. Для обнаружения в моче свободного фенола ее слабо подкисляют уксусной кислотой (доказано, что при часовом нагревании фенолсерных кислот с уксусной кислотой разложения их не происходит) и подвергают перегонке с водяным паром. Дистиллят нейтрализуют бикарбонатом натрия, извлекают эфиром и далее поступают, как описано при общем ходе исследования. Границей обнаружения фенола (по реакции образования трибромфенола) после дистилляции с водяным паром является 50—55 мг в 100 г биологического материала. При больших количествах фенола при насыщении им дистиллята ощущается характерный запах и заметны молочновидная муть и даже бесцветные или красноватые капли, растворяющиеся вследствие образования фенолята от добавления раствора гидроксида натрия. При малых количествах фенола, когда нет указанных выше признаков, нейтрализовав летучие кислоты бикарбонатом натрия (фенолы не реагируют с карбонатами щелочей), производят повторное извлечение дистиллята малыми порциями эфира. Извлечение имеет целью не только повышение концентрации фенола в растворе, но и освобождение дистиллята от кислот, особенно от молочной кислоты и этилового спирта, мешающих реакции обнаружения фенолов с хлоридом окисного железа. Эфирную вытяжку фильтруют через маленький фильтр, и эфир выпаривают при комнатной температуре. Остаток в виде маслянистых капель с резким запахом фенола растворяют в возможно малом объеме воды (2—3 капли); при большем количестве остатка берется большее количество воды. С раствором проделывают следующие реакции. 1. Реакция образования трибромфенола. К раствору прибавляют бромной воды — появляется белый осадок или образуется муть трибромфенола. Для контроля данную реакцию проводят с разбавленным раствором стандарта фенола. При микроскопическом исследовании сравнивают с препаратом, полученным из разведенного раствора фенола. Кристаллы имеют форму игл.
При большом избытке брома бромирование идет дальше, с переходом енольной формы фенола (такой переход часто наблюдается при реакциях фенолов) в кетоформу (производное дигидробензола):
Еще при концентрации 1:50 000 при продолжительном стоянии выделяется микрокристаллический осадок. Реакция чрезвычайно чувствительна: этим ограничивается ее химико-токсикологическое значение, так как некоторое количество фенола, главным образом его гомолога п-крезола, образуется в кишечнике из белка под влиянием бактерий и в еще большей степени при гниении трупа.
Фенол образуется, например, из тирозина, входящего в состав белковых тел. В бензольном кольце боковая цепь – -СН2-СНNH2-СООН окисляется, превращаясь в карбоксил, последнее соединение под влиянием фермента карбоксилазы разлагается и дает фенол: Осадок трибромпроизводного, кроме фенола, дает салициловая кислота —С6Н4-ОН-СООН и анилин — C6H5NH2. Однако салициловая кислота, переходя при подщелачивании дистиллята бикарбонатом натрия в соль, не извлекается эфиром и не может мешать обнаружению фенола. Реакции образования трибромфенола в ХТА придается значение только для доказательства отсутствия фенолов при ее отрицательном результате. 2. Реакция с хлоридом железа (III) Реакция фенолов с хлоридом железа (III) протекает в зависимости от рН среды и температуры с образованием комплексов различного состава. В случае фенола появляется синее или сине-фиолетовое окрашивание. Реакция специфична для фенольного гидроксила. Эту реакцию целесообразно проводить в капельном варианте на фильтровальной бумаге. Синее или сине-фиолетовое окрашивание объясняют образованием комплексов:
Окрашивание исчезает от кислот, избытка воды и этилового спирта, что и позволяет отличить фенол от салициловой кислоты, дающей ту же реакцию на фенольный гидроксил и летучей с водяным паром. Для отличия фенола от салициловой кислоты фильтрат перед извлечением эфиром нейтрализуют бикарбонатом натрия, переводя салициловую кислоту в соль, не извлекаемую эфиром. Реакция с хлоридом окисного железа для фенола менее чувствительна (1:1000), чем реакция с бромом, но это придает ей судебно-химическое значение, так как количество фенолов, образующихся в трупе вследствие гниения, не достигает, как правило, указанной концентрации. 3. Реакция образования индофенола. К части раствора добавляют 1 мл 1% раствора анилина и 2 мл раствора хлорной извести. Наблюдают появление грязно-фиолетового окрашивания, которое при добавлении 10% раствора аммиака переходит в синее.
Реакция является подтверждающей. Крезолы. Для изолирования крезолов используют перегонку с водяным паром, получая мутный диализат с резким удушливым запахом. С целью обнаружения используют реакции позволяющие отличить их друг от друга и от фенола.
Реакция Либермана. 1 – 2 капли раствора вносят в тигель и выпаривают досуха. К сухому остатку прибавляют каплю 1% раствора нитрита натрия в концентрированной серной кислоте. Через несколько минут смесь подщелачивают – появляется синее окрашивание, переходящее в красное, а затем в зеленое. Реакция с хлоридом железа (III). о-крезол и п-крезол образуют синее окрашивание, м-крезол – красно-фиолетовое, фенол – фиолетовое. Реакция с реактивом Миллона. К исследуемому раствору добавляют каплю реактива Миллона (смесь нитратов ртути (I), (II) и азотистой кислоты). Сразу или после нагревания образуется красное окрашивание. Реакция с бензальдегидом. К исследуемому раствору добавляют 2 мл концентрированной серной кислоты и 1 – 2 капли бензальдегида. При нагревании смеси появляется темно-красное окрашивание, которое при добавлении щелочи переходит в сине-фиолетовое. Индофенольная проба. Эту реакцию не дает п-крезол.
Количественное определение. Для количественного определения фенолов и крезолов дистилляцию производят до тех пор, пока качественные реакции (с бромной водой) не покажут отсутствия этих соединений. 1. При достаточном количестве фенола и крезола, о чем можно судить по результатам качественных реакций, может быть произведено весовое определение их в виде бром-производных. Кроме трибромфенола, образуется незначительное количество тетрабромфенола, но, принимая во внимание условность определения фенола при химико-токсикологическом анализе, этой ошибкой можно пренебречь. Количество фенолов, образующихся при гниении при сравнительно больших количествах находимого фенола, составляет ничтожную часть его и также не оказывает большого влияния на получаемые результаты. 2. При малых количествах возможно лишь объемное броматометрическое определение. В основу этого определения положены следующие реакции:
|