Раздел I. Введение в кинетику жидкофазных реакций. Структура жидкости
1. Лейкемоидная реакция по эозинофильному типу. 2. Анализ крови на паразитозы, стернальная пункция 3. Острый эозинофильный лейкоз, опистархоз.
Формы контроля освоения заданий по самостоятельной внеадиторной работе студентов по данной теме (тестовые задания, контрольные вопросы, ситуационные задачи)
Рекомендуемая литература Основная: 1. Внутренние болезни. В 2 т. / Под ред. А.И. Мартынова, Н.А., Мухина, В.С. Моисеева. – М.: ГЭОТАР-МЕД, 2008. 2. Внутренние болезни: учебник с CD. В 2 т. / Под ред. Н.А. Мухина, В.С. Моисеева, А.И. Мартынова. - М.: ГЭОТАР-Медиа, 2010. Дополнительная 1. Наглядная гематология [Текст]: переводное издание / перевод с англ. под ред. В. И. Ершова. - 2-е изд. - М.: Гэотар Медиа, 2008. - 115 с.: ил. - Предм. указ.: с. 111-115. - Прил.: с. 104-110. - Пер. изд.: Haematology at a Glance / A. B. Mehta, A. V. Hoffbrand. - 2nd ed. – 2006
2.Болезни системы крови [Текст]: учеб. - метод. пособие к практ. занятиям по дисциплине "Внутренние болезни" для студ., обучающихся по спец. "Педиатрия" / Башкирский гос. мед. ун-т, Кафедра факультетской терапии; под ред. Р. М. Фазлыевой. - 2-е изд., перераб. и доп. - Уфа: Изд-во БГМУ, 2008. - 140 с.
3.Гематология [Текст]: руководство для врачей / Б. В. Афанасьев [и др.]; под ред.: Н. Н. Мамаева, С. И. Рябова. - СПб.: СпецЛит, 2008. - 543 с.
Практическая и лабораторная гематология [Текст]: руководство / С. М. Льюис, Б. Бэйн, И. Бэйтс; пер. с англ. под ред. А. Г. Румянцева. - М.: Гэотар Медиа, 2009. - 670 с.: ил., табл. - Авторский коллектив указ. на с. 12. - Библиогр. в конце глав. - Пер. изд.: Practical haematology / S. M. Lewis, B. J. Brin, I. Bates. - 10th ed. - Edinburgh [etc.], 2006.
5.Хронический лимфолейкоз [Текст]: учебное пособие, рек УМО по мед. и фармац. образованию вузов России для системы послевузовского и доп. проф. образования врачей / под ред.: Б. А. Бакирова, Д. Х. Калимуллиной, А. Б. Бакирова. - Уфа: БГМУ, 2010. - 67 с. - В надзаг.: ГОУ ВПО "Башкирский государственный медицинский университет" Федерального агентства по здравоохранению и соц. развитию РФ, Институт последипломного образования. - Библиогр.: с. 60.
6.Тэмл, Харальд. Атлас по гематологии [Текст]: практическое пособие по морфологической и клинической диагностике / Харальд Тэмл, Диам Хайнц, Торстен Хаферлах; пер. с англ.: Т. С. Дальнова, С. Г. Василиу-Светлицкая; под общ. ред. проф. В. С. Камышникова. - М.: МЕДпресс-информ, 2010. - 207 с.:
7.Рациональная фармакотерапия заболеваний системы крови [Текст]: руководство для практикующих врачей / под общ. ред. А. И. Воробьева = Rationale for drug therapy of blood disorders: A Guidebook for medical practitioners / A. I. Vorobiev. - М.: Литера, 2009. - 688 с.
http://www.studmedlib.ru/book/ISBN9785970414217.html. http://www.studmedlib.ru/book/ISBN9785970413975.html. http://ovidsp.tx.ovid.com.
Раздел I. Введение в кинетику жидкофазных реакций. Структура жидкости Тема 1. Диффузионный и кинетический контроль в кинетике жидкофазных реакций Цель настоящего курса – изложение современных представлений о влиянии растворителя на скорости элементарных стадий химических реакций
Экскурс в 3 курс: в рамках формальной (газофазной) кинетики рассматриваются моно- и бимолекулярные реакции. В случае реакции в жидкости вводится стадия транспорта реагентов, за которой следует собственно реакция
Где k kin и k D отвечают константам скорости реакции и диффузионного сближения, соответственно. Можно выделить две области: 1) k kin >> k D, диффузионный контроль, k obs @ k D @ 1010 M-1c-1 2) k kin << k D, кинетический контроль, k obs @ k kin Далее мы получим выражение (1.1) исходя из уравнения диффузии и формальных кинетических соображений на примере 2-х простых моделей.
Модель 1 (Диффузионных пар)
Если у нас k 1 << k diss, то k obs = (k ass/ k diss) k 1 = KAB k 1, где KAB = 4pR2dR - константа равновесия между реагентами и диффузионными парами, равная вероятности найти B в объеме клетки вблизи А (на расстоянии контакта R в слое толщиной dR). Покажем, что выражения для k obs (1.1) и (1.2) эквивалентны.
Рассмотрим частицы А и В в общем объеме V. Пусть V* – объем клети, где есть А. По Модели 1:
Модель 2. (по Теории Смолуховского с использованием закона Фика) Предположим, что: А) Реагенты находятся в состоянии теплового равновесия, Б) Задано начальное распределение частиц в пространстве, В) Выполняется закон Фика: макроскопическая диффузия D – коэффициент диффузии [см2/с]. Размерность j [ молекула´ см-2´сек-1 ]
В этих приближениях рассмотрим полный поток (Ф) частиц В в направлении одной из частиц А. Учтем что у нас есть сферическая симметрия. Если реакции нет, то поток равен нулю. Если же идет реакция, то величина потока равна скорости реакции ([ молекула´ см-3´сек-1 ]):
Примечание: в выражении (1.3) сравниваются величины потока и скорости реакции, ибо впрямую они не сравнимы: поток – векторная величина, а скорость – скалярная!
Из выражения (1.3) получается граничное условие 3-рода:
Считаем, что реакция протекает при контакте реагентов, посчитаем скорость на контакте. Положим, что реакция есть бимолекулярный процесс, описываемый законом действующих масс:
Выражение (1.5) называется формулой Дебая – Смолуховского и тождественно (1.1) с точностью до обозначения. (k 2 = k kin, k D = 4pRD). Таким образом, мы придали физический смысл диффузионной константе скорости, ее размерность [см3´сек-1´молекула-1] Если решать задачу с нестационарным потоком, то Вязкость. Уравнение Стокса – Эйнштейна. Численная оценка k D. По закону Стокса сила, действующая на движущуюся частицу: F = 6phan, где h - вязкость растворителя, а – радиус частицы, n - скорость. Формула выведена для крупных частиц, по размерам сильно превосходящих молекулу растворителя. Найдем связь вязкости и коэффициента диффузии. Вспомним определение химического потенциала: В стационарных условиях эта сила уравновешивается силой трения:
Плотность диффузионного потока частиц по определению потока: Размерность коэффициента вязкости [г´сек-1´см-1] – [пуаз]. Характерные значения для воды 1 сПз, метанола – 0.6 сПз, глицерна – 149 сПз, этиленгликоля 19 сПз.
Теперь мы можем оценить по уравнению С-Э коэффициент диффузии:
Оценим теперь величину диффузионной константы скорости
Оценка частоты столкновений в жидкости Рассмотрим реакцию в жидкости как реакцию в очень плотном газе, берется формула из газофазной кинетики
В формуле для константы полностью отсутствует связь с параметрами растворителя. В эксперименте наблюдается два факта: Медленные реакции – нет влияния вязкости растворителя, быстрые – зависимость от 1/h. Для объяснения рассматриваются два типа соударений: 1) «первые встречи» - образование диффузионной пары из реагентов 2) Соударения во время жизни диффузионной пары Число «первых встреч», Zв ~ 1/h. Число соударений в паре растет с увеличением вязкости n~ h. Соответственно общее число столкновений Z ~ Zв n ~ const. Если скорость реакции мала, то константа пропорциональна Z и не зависит от вязкости. Если же скорость велика, то все определяется «первыми встречами» и константа зависит от 1/h.
(число столкновений за 1 с в 1 см3 при концентрации реагентов 1 частица в см3). Надо сказать, что данная величина близка к газокинетической, так как скорость поступательного движения в газе близка по величине к скорости колебаний в жидкости). Если взять тепловую скорость n = = 3´104 см/с, оценим время одного столкновения в жидкости
Итоги:
Тема 2. Представление о структуре жидкости
Исторически вначале жидкость рассматривалась как очень плотный газ. В первых работах пытались перенести газовую теорию столкновений на жидкость. Особого успеха не было.
 На самом деле жидкость имеет квазикристаллическую структуру. Существует ближний порядок в пределах 2-3 координационных сфер. Если мы введем На самом деле жидкость имеет квазикристаллическую структуру. Существует ближний порядок в пределах 2-3 координационных сфер. Если мы введем
(для сферически симметричных частиц) радиальную функцию распределения: найти второй атом в слое (r, r + dr), W(r) – радиальная функция распределения частиц, такая что интеграл от W(r) по всему объему равен 1. (т.е. мы всегда найдем вторую частицу во всем объеме)
Виды распределения для систем из несжимаемых шаров радиуса R
Ближний порядок в жидкости в значительной степени представляет собой плотностной эффект. Если моделировать жидкость твердыми шарами, то получиться функция распределения, характерная для ближнего порядка. Однако, плотнейшая упаковка, характерная для кристаллов, в жидкостях не реализуется. Скажем, для воды (радиус 1.4 А) расчет для плотнейшей упаковки (координационное число 12, КГЦ решетка) дает плотность 1.89, при истинной плотности 1.0.
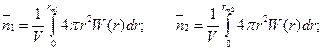 где V – объем молекулы, rm1 и rm2 – координаты первого и второго максимумов W(r). где V – объем молекулы, rm1 и rm2 – координаты первого и второго максимумов W(r).
Движение в квазикристаллической среде Модель трансляционной диффузии Френкеля: «Тепловое движение частиц жидкости есть нерегулярные колебания с частотой 1/t0, где t0 – период колебания частицы в клетке».
E′; - свободная энергия активации движения vср – средняя скорость перемещения частицы rср - среднее расстояние между узлами решетки
Взаимное перемещение частиц характеризуется коэффициентом самодиффузии: r2ср = 6Dt (Соотношение Энштейна). Отсюда:
Если принять что t0 ~ 10-13 с, rср = 1 А, то получим максимальный коэффициент самодиффузии 10-3 см2 / с. Реальные коэффициенты – порядка 10-5 см2 / с, что позволяет оценить энергию активации диффузионного движения – порядка 4kТ или 2.4 ккал / моль, т.к. kТ = 0.6 ккал /моль.
В зависимости от характерного времени процесса можно выделить три типа структуры жидкости (из Энтелиса и Тигера):
1) t << t0 Мгновенная структура ближнего окружения частицы. Для этого временного диапазона уровень флуктуации координационных чисел очень велик (40-50% для n2).
2) t0 << t << t - средняяструктура ближнего окружения частицы. Если выделить вокруг некоторой частицы m соседей (m = 10-20), то за время) t0 < t < t/m центры колебаний этой группы будут неподвижными – квазикристалличность.
3) t >> t (равновесные процессы) Квазикристалличность утрачивается, есть только радиальная плотность распределения и ближняя упорядоченность
Рассматривают две модели диффузии – прыжковую (малые молекулы) и континуальную (большие молекулы). Обе модели дают одинаковые результаты при длине прыжка сравнимой с радиусом контакта молекул. Поэтому далее все рассмотрение идет в рамках континуальной модели.
|

 (1.1)
(1.1)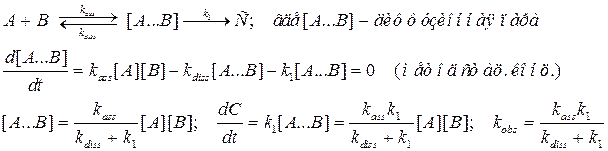 (1.2)
(1.2)

 Таким образом, получено выражение, полностью совпадающее с (1.1) при переобозначении констант (k ass = kD, k 1V* = k 2). Следует отметить, что мы получили известное из формальной кинетики выражение, что бимолекулярная константа есть произведение мономолекулярной на реакционный объем.
Таким образом, получено выражение, полностью совпадающее с (1.1) при переобозначении констант (k ass = kD, k 1V* = k 2). Следует отметить, что мы получили известное из формальной кинетики выражение, что бимолекулярная константа есть произведение мономолекулярной на реакционный объем. , где
, где (1.3)
(1.3) Отсюда:
Отсюда: . Интегрируем с учетом граничного условия СB(r®∞) = CB.
. Интегрируем с учетом граничного условия СB(r®∞) = CB. (1.4)
(1.4)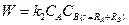 . Подставляя это выражение для скорости в (1.4) получим:
. Подставляя это выражение для скорости в (1.4) получим:
 . Стационарный поток устанавливается за время t >> R2/D. (Оценка при R = 5 A и D = 2.5´10-5, t >> 100 пс).
. Стационарный поток устанавливается за время t >> R2/D. (Оценка при R = 5 A и D = 2.5´10-5, t >> 100 пс). . Если у нас есть градиент концентрации, то можно ввести диффузионный поток под действием формальной силы:
. Если у нас есть градиент концентрации, то можно ввести диффузионный поток под действием формальной силы:  .
. (1.6)
(1.6) (по закону Фика) откуда сравнивая с (1.6) получаем:
(по закону Фика) откуда сравнивая с (1.6) получаем:  . Это уравнение Стокса – Эйнштейна. Для очень маленьких частиц (газов)
. Это уравнение Стокса – Эйнштейна. Для очень маленьких частиц (газов)  .
.


 , где r - стерический фактор, Z - общее число столкновений, exp(…) – доля активных столкновений. В газофазной кинетике:
, где r - стерический фактор, Z - общее число столкновений, exp(…) – доля активных столкновений. В газофазной кинетике:

 . Второй тип столкновений (в клетке):
. Второй тип столкновений (в клетке):  - характерное время существования клетки. За время жизни клетки частица испытывает порядка 100 столкновений.
- характерное время существования клетки. За время жизни клетки частица испытывает порядка 100 столкновений. ;где V* -характерный объем клетки. Существует два вида контроля и два вида столкновений в жидкости. Число повторных контактов в клетке – порядка 100.
;где V* -характерный объем клетки. Существует два вида контроля и два вида столкновений в жидкости. Число повторных контактов в клетке – порядка 100.
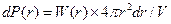 , где dP(r) – вероятность
, где dP(r) – вероятность








