Ход работы. 1. Перед опытом собирают установку для переваривания белков, внешний вид которой и схема устройства представлены на рис
1. Перед опытом собирают установку для переваривания белков, внешний вид которой и схема устройства представлены на рис. 16-17.
Установка содержит несколько 6 последовательно соединенных ячеек (I, II, III, IV) (рис. 17). Много ячеек позволяет одновременно вести 1 опыт. сразу в многократной повторности, либо провести опыт по перевариванию разных белковых продуктов. Каждая из ячеек состоит из вставленных один в другой двух стаканов А и В, разделенных полупроницаемой мембраной - 4. Внешний стакан А имеет рубашку, которая заполняется водой, поступающей из термостата. Дно внутрен него стакана В представляет собой полупроницаемую мембрану. Стакан В снабжен мешалкой – 1. 2. 0,5 г измельченного продукта или чистого белка тщательно растирают в ступке с небольшим количеством глицинового буферного раствора с рН 2,2, взятого из общего исходного объема 15 мл, и количественно переносят во внутренний стакан В, используя для смыва оставшийся буфер. В наружный стакан А помещают столько того же глицинового буфера, чтобы уровень жидкости в обоих стаканах был одинаковым. 3. Прибор подключают к водяному термостату с температурой 37 0С и выравнивают 10-15 мин температуру в стаканах. 4. Во внутренний стакан вносят 15 мг пепсина. Концентрация пепсина при этом составляет 1 мг/мл, что соответствует средней его концентрации в желудочном соке. Устанавливают и включают мешалку. Переваривание ведут 2 – 3 часа.
5. Через каждые 20 мин отбирают пробы гидролизата. Для этого отклюю- чают мешалку, осторожно вынимают внутренний стакан В и отбирают пипеткой из наружного стакана А вчистую пробирку точно 2 мл раствора гидролизата, содержащего аминокислоты. 6. Определение прироста продуктов гидролиза белка пепсином проводят по аминокислоте тирозину, которая дает с реактивом Фолина синее окрашивание. Для этого в каждую опытную пробирку добавляют по 4 мл 0,5 н гидроксида натрия и по 1мл реактива Фолина. Растворы перемешивают и выдерживают 10 мин для развития окраски. Параллельно готовят контрольный раствор, для этого в пробирку вносят 2 мл глицинового буфера с рН 2,2, 4 мл 0,5 н гидроксида натрия и 1мл реактива Фолина. 7. В окрашенных опытных растворах определяют оптическую плотность – D на фотоэлектроколориметре при λ = 630 нм (светофильтр № 8) против контрольного раствора в кювете с рабочей длиной 10 мм. 8. По градуировочному графику по найденным значениям оптической плотности в исследуемых растворах находят концентрацию тирозина в мкг/мл (рис. 18). 9. Активность пепсина в ТЕ (тирозиновых единицах) рассчитывают по Формуле
А= Стир /τ [ТЕ], (11)
где Стир – концентрация тирозина за определенное время переваривания, мкг/мл; τ – время переваривания, мин.
10. Результаты работы представляют в виде графика кинетики переваривания белка пепсином, в котором по оси ординат откладывают найденные по градуировочному графику значения концентрации тирозина в мкг/мл в исследуемых пробах, а по оси абсцисс – время переваривания в мин. 11. Если в работе одновременно проводили переваривание разных пищевых продуктов, то после окончания опыта по кинетическим кривым, полученным на графике (см. п. 9) можно сравнить степень переваривания этих продуктов и сделать вывод об их пищевой ценности.
Примечание:при определении дальнейшей степени переваривания белка трипсином опыт продолжают. Для этого раствор во внутреннем стакане нейтрализуют 2 н гидроксидом натрия и добавляют 0,2 н гидроксид натрия до щелочной среды с рН 8,4. В наружный стакан после удаления кислого буфера добавляют щелочной глициновый буфер с рН 8,4 так, чтобы уровень жидкости в стаканах был одинаковым. Затем во внутренний стакан вносят 15 мг трипсина. Остальные операции проводят также, как и в опыте с пепсином
Рис.18. Градуировочный график для определения концентрации тирозина
|

 Рис. 16. Внешний вид установки для переваривания белков
Рис. 16. Внешний вид установки для переваривания белков
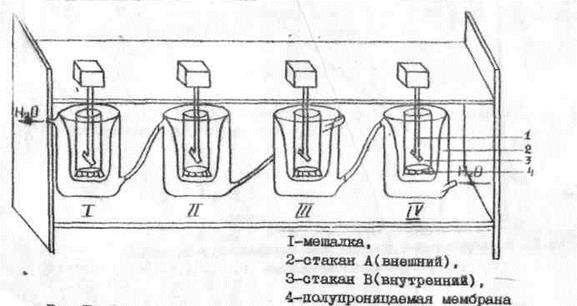 Рис. 17. Схема устройства для переваривания белков
Рис. 17. Схема устройства для переваривания белков





