Дополнительные устройства визуализации клеток в культуре.
Метод фазового контраста. Предназначен для получения изображений прозрачных и бесцветных объектов, невидимых при наблюдении по методу светлого поля. К таковым относятся, например, живые неокрашенные животные ткани. Суть метода в том, что даже при очень малых различиях в показателях преломления разных элементов препарата световая волна, проходящая через них, претерпевает разные изменения по фазе (приобретает т. н. фазовый рельеф). Получаемое таким образом изображение называется фазово-контрастным. Устройство фазового контраста включает в себя специальные конденсор и набор объективов, которые устанавливаются вместо обычного на микроскоп.
Рис… Фазово-контрастный набор к световым микроскопам: 1- конденсор и объективы фазового контраста, 3- центрирующее устройство для настройки. Фото клеток по методу светлого поля (4) и фазового контраста (5).
Метод дает возможность различать малые элементы структуры, чрезвычайно слабо контрастные в методе светлого поля. Существуют различные модификации этого метода в основу которого заложены различные конструктивные изменения в строении оптической системы конденсора и объективов.
Устройство Варел-контраста (VAREL-contrast). Является модификацией метода фазового контраста. Контрастирование связано с изменением интенсивности света, прошедшего через объект, отличающийся по толщине от однородной среды. При движении объекта он освещается то с одной, то с другой стороны, что создает эффект косого освещения.
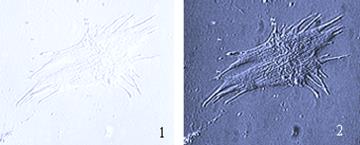
Рис… Фото клетки в проходящем свете (1) и с использованием метода Варел-контраста (2).
Устройства рельефного фазового контраста (Relief Phase Contrast – RPC): Хоффман-контраст (Hoffman-contrast) - один из первых методов объемного изображения, позволяющих работать с объектами, находящимися в пластиковой посуде. Хоффмановский контраст позволяет создавать псеводорельефные изображения неокрашенных и двоякопреломляющих препаратов (например, живых клеток в пластиковых чашках для культивирования). Это метод косого освещения, повышающий контраст в окрашенных и неокрашенных препаратах. При методе Хоффмановского модуляционного контраста также отсутствует эффект гало, иногда наблюдаемый при работе по методу фазового контраста. Разновидностью Хоффман-контраста является Интегрально-модуляционный контраст (Integrated Modulation Contrast – IMC).
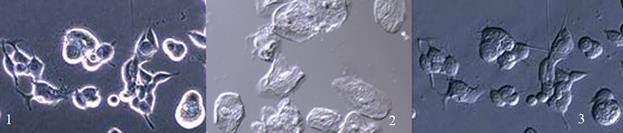
Рис… Фото клеток в проходящем свете (1), по методу Хоффман-контраста (2) и IMC (3).
Дифференциально-интерференционный контраст (ДИК, DIC-contrast) - это дальнейшее развитие фазово-контрастного микроскопа. Для освещения объекта свет от источника предварительно поляризуется () до объектива. Создается эффект объемности за счет различий в интенсивностях освещенности деталей в конечном изображении. С помощью данного метода получается монохроматическое оттененное изображение.
ПласДИК (PlasDIC) – модификация ДИК-контраста. В отличие от классического ДИК-контраста, поляризация света происходит после объектива в световом потоке, строящем изображение, т.е. после пластиковой посуды (объекта). Таким образом удается избежать цветных искажений.
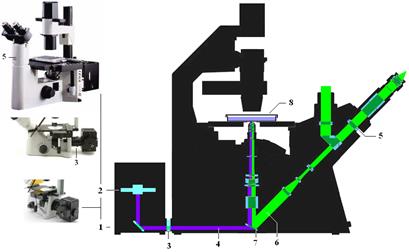
Рис… Фото клеток по методу классического фазового контраста (1), ДИК-контраста (2), ПласДИК-контраста (3). Метод флуоресцентной микроскопии. Флуоресцентная (люминесцентная) микроскопия основана на способности некоторых веществ (флуорохромов) люминесцировать, т. е. светиться при освещении их светом (возбуждение) с определенной длиной волны. Цвет (длина волны) люминесценции смещен в более длинноволновую часть спектра по сравнению с возбуждающим ее светом (правило Стокса). Прикрепляя различными методами флуорохромы к биологическим молекулам можно заставить их светиться в определенном диапазоне спектра, визуализировать их, а анализируя спектр свечения определять их функциональное состояние, концентрацию и т.д. Устройство флуоресцентного микроскопа отличаются от обычного светового микроскопа в основном следующим (Cм. Рис…): 1. Наличие мощного источника света в осветителе (1), излучающего преимущественно в коротковолновой (ультрафиолетовой, синей) части спектра - ртутно-кварцевая лампа или галогенная кварцевая лампа (2). 2. Наличие системы светофильтров: возбуждающие светофильтры (3) пропускают только ту часть спектра, которая возбуждает люминесценцию (4); "запирающие" светофильтры (5) расположены между окуляром. Эти светофильтры поглощают возбуждающее излучение (4) и пропускают свет люминесценции (6) от препарата к глазу наблюдателя. Важную роль при этом способе освещения играет специальная интерференционная светоделительная пластинка (7), направляющая свет в объектив и на объект исследования (8). Она представляет собой полупрозрачное зеркало, которое избирательно отражает и направляет в объектив часть спектра, которая возбуждает люминесценцию (4), а пропускает в окуляр свет люминесценции (6).
Оптика объективов флуоресцентного микроскопа изготавливается из нелюминесцирующих сортов оптического стекла, часто кварца, и склеивается специальным нелюминесцирующим клеем. При работе с объективами масляной иммерсии используется нелюминесцирующее иммерсионное масло. Применение флуоресцентной микроскопии: Изучение морфологии клеток – за счет высокого контраста цветного изображения. Первичное выявление и подсчет живых и мертвых клеток. Основано на способности ДНК к флуоресценции при связывании с специфическими красителями, причем спектр люминесценции будет зависеть от структурно-функционального состояния ДНК. Визуализация и исследование клеточных микроструктур и макромолекул. Существует три принципа окрашивания клеточных микроструктур в зависимости от задач исследования. Первый – окрашивание флуоресцирующими красителями после фиксации клетки. Второй – окрашивание после фиксации клетки специфическими антителами конъюгированными с красителем. Третий – встраивание в геном клетки модифицированного гена (вектора) ответственного за выработку изучаемого продукта, белка, например. Причем ген модифицирован так, что клетка будет производить белок обладающий способностью к флуоресценции. В отличии от первых двух методов, третий способ позволяет наблюдать динамику изменений экспрессии генов изучаемого белка, например, его концентрации в режиме реального времени без фиксации препарата. Цитохимическая индикация функциональных параметров клеток – встраивание в мембрану или внутриклеточные органеллы клетки флуоресцентной метки, которая будет менять интенсивность или спектр флуоресценции в ответ на изменение физиолого-биохимических параметров вне- или внутри клетки. Например, на изменение внутриклеточного рН.
Разновидностью флуоресцентной микроскопии является конфокальная микроскопия. Конфокальный микроскоп отличается от "классического" оптического микроскопа тем, что в каждый момент времени регистрируется изображение одной точки объекта, а полноценное изображение строится путем сканирования последовательно всех точек объекта. Для этого в качестве осветителя объекта используется лазерный луч. Использование лазерных лучей с различными длинами волн возбуждения сопрягает конфокальную микроскопию с классической люминесцентной. Качественно понятно, что применение конфокальной схемы должно приводить к увеличению контрастности изображения, за счет того, что "паразитный" свет от точек соседних с анализируемой перестает попадать в детектор. Наиболее часто встречающейся задачей для конфокальной микроскопии, благодаря ее высокому разрешению и контрасту, является изучение структуры клеток и их органелл, например, цитоскелета, ЭПР, лизосом, митохондрий, ядра, хромосом и даже генов. Исследуется также cо-локализация в клетке двух и более веществ. Еще одна задача – исследование динамических процессов, происходящих в живых клетках. Например, клеточного транспорта биологически-активных соединений. Записав в памяти компьютера серию оптических срезов, можно провести объемную реконструкцию объекта и получить его трехмерное изображение, не используя трудоемкую методику изготовления и фотографирования серийных гистологических срезов. Метод электронной микроскопии. Электронная микроскопия - метод исследования микроструктуры твердых тел, их локального состава и микрополей (электрических, магнитных и др.) с помощью электронных микроскопов - приборов, в которых для получения увеличенных изображений используют электронный пучок. Различают два главных направления электронной микроскопии: трансмиссионную (просвечивающую) и растровую (сканирующую). Они дают качественно различную информацию об объекте исследования и часто применяются совместно. Трансмиссионная микроскопия реализуется с помощью трансмиссионных (просвечивающих) электронных микроскопов (ТЭМ), в которых тонкопленочный объект просвечивается пучком ускоренных электронов с энергией 50-200 кэВ. Электроны, отклоненные атомами объекта на малые углы и прошедшие сквозь него с небольшими энергетическими потерями, попадают в систему магнитных линз, которые формируют на люминесцентном экране (и на фотопленке) светлопольное изображение внутренней структуры. При этом удается достичь разрешения порядка 0,1 нм, что соответствует увеличениям до 1,5 х 106 раз. Рассеянные электроны задерживаются диафрагмами, от диаметра которых в значит, степени зависит контраст изображения. При изучении сильнорассеивающих объектов более информативны темнопольные изображения. В растровых электронных микроскопах электронный луч, сжатый магнитными линзами в тонкий (1-10 нм) зонд, сканирует поверхность образца, формируя на ней растр из нескольких тысяч параллельных линий. Возникающее при электронной бомбардировке поверхности вторичные излучения (вторичная эмиссия электронов) регистрируются различными детекторами и преобразуются в видеосигналы. Преимуществом сканирующей электронной микроскопии является возможность получения высококонтрастных объемных изображений. При исследовании тонких пленок (в т.ч. монослоя клеток) повышают их контраст обработкой соединениями тяжелых металлов (Os, U, Pb и др.), которые избирательно взаимодействуют с компонентами микроструктуры (химическое контрастирование). Атомно-силовая микроскопия. Атомно-силовой микроскоп (АСМ, AFM — atomic-force microscope) — сканирующий зондовый микроскоп высокого разрешения, основанный на взаимодействии специального механического зонда (кантилевера) с поверхностью исследуемого образца. Взаимодействие зонда с поверхностью образца обуславливается притяжением или отталкиванием зонда, вызванные силами Ван-дер-Ваальса. Атомно-силовой микроскоп способен измерять рельеф образца, погружённого в жидкость, что позволяет работать с органическими молекулами, включая ДНК. В отличие от растровой электронной микроскопии, который даёт псевдотрёхмерное изображение поверхности образца, АСМ позволяет получить истинно трёхмерный рельеф поверхности. Кроме того, возможность исследовать методом АСМ непроводящие поверхности, не требует нанесения проводящего металлического покрытия, которое часто приводит к заметной деформации поверхности. Для нормальной работы электронного микроскопа требуется вакуум, в то время как большинство режимов АСМ могут быть реализованы на воздухе или даже в жидкости. Данное обстоятельство открывает возможность изучения биомакромолекул и живых клеток.
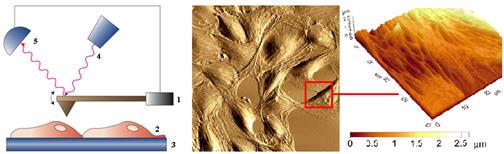
Зонд-игла (1) «плавает» по поверхности клетки на субстрате (2-3) на уровне Ван-дер-Ваальсовых сил притяжения-отталкивания. Перемещения зонда регистрируется по отклонению луча лазера (4) регистрируемое фотоприемником (5). В результате получается объемное, трехмерное изображение поверхности клетки.
ПРАВИЛА РАБОТЫ ПЕРСОНАЛА.
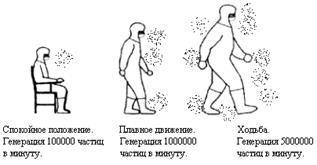
Одежда. Каждый, кто работает в культуральном боксе должен иметь свой индивидуальный набор одежды и обуви, предназначенный для работы в «чистом помещении» и только. Как правило, используется минимальный набор: медицинская одежда, одноразовые больничные бахилы поверх сменной обуви, больничная целофановая шапочка на голову, марлевая повязка, хирургические перчатки. Материал одежды должен быть безворсовым и как можно меньше электризоваться, чтобы она не превращалась в «пылесборник» даже на то короткое время перехода персонала из общего помещения в бокс. В мире и в Украине в частности существует индустрия производства специальной одежды для «чистых комнат» одно- и многоразового использования, которая отвечает международным нормам к одежде такого класса. В любом случае каждый день после окончания работ в культуральном боксе одежда должна стерилизоваться, а все одноразовые элементы одежды (бахилы, перчатки, маски) утилизироваться и повторно не использоваться. Переодевается персонал в предбокснике. Личная гигиена. Бессмысленно мыть стены бокса спиртом, если работник не моет перед заходом в него рук. Человек – мощный потенциальный источник бактерий, спор грибов и летучих микроскопических частиц. В связи с этим, фактор чистоты персонала культурального бокса находиться на первом месте, поскольку именно человек является единственным объектом культуральной лаборатории, который попеременно напрямую контактирует и с продуктом – культурой клеток (в боксе), и с окружающей средой (вне бокса). Наиболее жесткие требования к персоналу на производстве, особенно зарубежном, где существуют особые службы, отбирающие и контролирующие для работы в «чистой зоне» персонал исходя из состояния покровов кожи, наличию перхоти и т.д. При этом это вызвано отнюдь не заботой о персонале, а стремлением защитить клеточную культуру. Так, например, повышенная чувствительности к аллергенам может вызвать насморк и чихание работника, и, как следствие – распространение микрочастиц в боксе из дыхательных путей. Это в условиях производства сильно дорогостоящий риск, поэтому и требования к персоналу на фармпроизводстве, где задействованы культуральные технологии, очень жесткие. В научно-исследовательской лаборатории как правило нет контролирующего органа за состоянием чистоты, но ученый-исследователь должен сам максимально следить за собой. Понятно, что общепризнанные правила личной гигиены обязательны. После переодевания необходимо протереть участки тела, которые будут оставаться открытыми в боксе, стерильным бидистиллятом, а также прополоскать им рот, чтобы убрать механические частицы (споры, чешуйки эпителия, пыль). Для женщин пользоваться косметикой перед заходом в бокс крайне нежелательно. Все, что наноситься или одевается на тело (мази, лосьены, часы, украшения т.д.) нужно рассматривать как источник загрязнения бокса, дополнительный риск для культуры клеток. Правила поведения. При серьезном подходе, никакие предметы не должны вноситься в чистое помещение, если они не нужны для работы. В реальности же это правило редко выполняется и некоторые необходимые личные вещи вносятся в бокс, предварительно поместив их в герметичную стерильную упаковку. Если, например, сил нет оставить на время любимый мобильный телефон, то его нужно перед заходом в бокс положить в герметично закрывающийся целлофановый чехол, который обрабатывается спиртом. Категорически запрещается вносить в культуральный бокс бумагу, ткани, пищу, напитки т.д., т.е все, что является предметами-пылесборниками или источниками микрочастиц. При входе и выходе из бокса не следует резко открывать двери, так как это вызывает дополнительное перемещение воздуха из предбоксника в бокс. Не допускается легкомысленное поведение, движение должны быть четкими, но плавными. Скорость отделения частиц от персонала прямо пропорциональна его активности Работа с «продуктом». Несмотря на то, что все операции с культурами проводятся под ламинаром в стерильных условиях, существует четкие рекомендации по проведению манипуляций с культурами, призванные снизить риск их загрязнения. Руки персонала никогда не располагаются над открытым «продуктом» и никогда не должен обдуваться ламинарным потоком в сторону культуры, даже в перчатках. Над культурой обычно располагается только стерильные предметы (наконечник дозатора или пипетки и т.д.). Все предметы под ламинаром располагаются по градиенту чистоты – вглубь ламинара помещаются наиболее чистые предметы (например постоянно находящееся только под ламинаром набор дозаторов), ближе к краю рабочей зоны – временные, сменяемые аксессуары (шприцы, одноразовые пипетки и т.д.). Это нужно для того, чтобы поток стерильного воздуха не переносил возможные остаточные загрязнения с вносимых под ламинар извне предметов. Руководствуясь вышесказанным, перед работой под ламинаром, необходимо сначала в голове провести все манипуляции и телодвижения, составить четкий план работы. Существуют и непредвиденные обстоятельства, при этом рука, например, которая в процессе работы «покинула» рабочую зону ламинара (взять что либо, например) должна перед возобновлением работы быть обработана спиртом.
КУЛЬТУРАЛЬНАЯ ПОСУДА И РАСХОДНЫЕ МАТЕРИАЛЫ
Посуда для работы с культурами клеток максимально унифицирована во всем мире. Это во-первых связано с тем, что культуры клеток очень чувствительный объект исследования, и данные, которые получают ученые е во всем мире, должны быть максимально воспроизводимы. А во-вторых, эта посуда должна быть совместима с используемым оборудованием (микроскопы, фотометры, инкубаторы и т.д.). Отсюда и некие общепринятые стандарты объемов, диаметров, качества материала и т.д. культуральной посуды, или как еще говорят – культурального пластика.
Культуральные планшеты. Культуральные планшеты используют в зависимости от поставленной задачи. Как правило, они изготавливаются из пластика с адгезивным покрытием или без него. К планшетам, которые планируется использовать для дальнейшего высокочувствительного анализа растущих в них клеток предъявляются особые требования материала, которые нужно уточнять у поставщика. Так, например, при использовании таких методов, как планшетная колориметрия, флуориметрия и конфокальная микроскопия, желательно использовать планшет из черного пластика с дном из фтороуглеродной пленки, минимализирующей искажения флуоресцентного изображения или регистрацией приборами интенсивности окрашивания или флуоресценции исследуемого объекта в лунках планшета.
Следует четко понимать разницу между культуральными планшетами и планшетами диагностическими – например, иммунологическими и ПЦР-планшетами. Эти планшеты служат для анализа продуктов метаболизма клеток и их поверхность неприспособленна для адгезии и роста клеток.
Фильтры-насадки на шприцы. Используется для подготовки проб, очистки и стерильной фильтрации малых объемов жидкостей до 100 мл. При выборе фильтра для работы, в зависимости от поставленной задачи, нужно учитывать материал фильтрующей мембраны, диаметром пор мембраны, и объем фильтруемой жидкости. Материалом мембраны может быть ацетат целлюлоза, полиэфирсульфон, регенерированная целлюлоза,
Скребки. Используют для эффективного удаления адгезивных клеток с поверхности культуральных сосудов. Лезвие скребка обычно изготавливается из полиэтилена, во избежание повреждения клеток. Выпускаются с поворотным лезвием (для облегчения снятия клеток с труднодоступных мест флакона – в углах или под горлом) и с фиксированным лезвием.
МЕТОДЫ СТЕРИЛИЗАЦИИ И ДЕЗИНФЕКЦИИ Санитарная обработка помещений - одно из важнейших мероприятий по обеспечению чистоты. Цель такой обработки - сведение к минимуму механических и микробных загрязнений. Залог чистоты «чистого помещения» должен начинаться еще с обустройства культуральной лаборатории. Для лабораторий, производящих какой либо продукт фармакологического или медицинского назначения, существуют так называемые правила GMP (Good Manufacturing Practice) по организации помещений лаборатории, вплоть до материалов стен, пола и т.д. Для обычных научно-исследовательских лабораторий, не преследующих цель лицензировать какой либо продукт своей деятельности, следовать этим правилам не обязательно, но стремиться к ним нужно. Стены, пол и потолок культурального бокса покрывают листовым металлом, керамической плиткой, пластмассами или эмалями. Все поверхности, по возможности, должны быть гладкими, легко моющимися, а сопряжения стен между собой и стен с полом желательно, чтобы были закруглены. Используемые материалы для их покрытия должны выдерживать обработку антисептическими средствами и ультрафиолетом и не способствовать накоплению пыли в швах, стыках и т.д.
|



 (Рис…).
(Рис…).
 Культуральные флаконы (матрасы) и чашки Петри. Особенности, на которые следует обращать при работе с культуральным матрасом – наличие встроенного HEPA-фильтра в крышке (А). Эта так называемая вентилируемая крышка обеспечивает, во-первых, улучшение газообмена культуры, а во-вторых, дополнительно снижает риск заражения культуры из воздуха вне флакона. Такая вентиляция необходима для роста ряда нормальных адгезионных культур (фибробластов, эпителиальных клеток, например). Для суспензионных культур (лейкоциты, например) такая вентиляция не нужна (Б). Стоит также обращать внимание на материал матраса или чашки. Если планируется использовать флуоресцентную микроскопию клеток, то необходимо узнать, не обладает ли материал посуды аутофлуоресценцией. Кроме того, в зависимости от нужд исследователя, выпускаются культуральные флаконы и чашки Петри с так называемой «обработанной поверхностью» – покрытием из ряда веществ, стимулирующих в той или иной степени прикрепление клеток адгезионных культур ко дну - коллагеном, полилизином и др.
Культуральные флаконы (матрасы) и чашки Петри. Особенности, на которые следует обращать при работе с культуральным матрасом – наличие встроенного HEPA-фильтра в крышке (А). Эта так называемая вентилируемая крышка обеспечивает, во-первых, улучшение газообмена культуры, а во-вторых, дополнительно снижает риск заражения культуры из воздуха вне флакона. Такая вентиляция необходима для роста ряда нормальных адгезионных культур (фибробластов, эпителиальных клеток, например). Для суспензионных культур (лейкоциты, например) такая вентиляция не нужна (Б). Стоит также обращать внимание на материал матраса или чашки. Если планируется использовать флуоресцентную микроскопию клеток, то необходимо узнать, не обладает ли материал посуды аутофлуоресценцией. Кроме того, в зависимости от нужд исследователя, выпускаются культуральные флаконы и чашки Петри с так называемой «обработанной поверхностью» – покрытием из ряда веществ, стимулирующих в той или иной степени прикрепление клеток адгезионных культур ко дну - коллагеном, полилизином и др. Кроме того, в зависимости от операций, которые планируется проводить с клетками в планшете, можно выбрать планшеты со съемными лунками-вкладышами, например.
Кроме того, в зависимости от операций, которые планируется проводить с клетками в планшете, можно выбрать планшеты со съемными лунками-вкладышами, например. Дозирующие приспособления. Для дозирования жидкостей (объемы от 1 мл) обычно используют стерильные серологические пипетки однократного использования (А) и автоматические дозаторы (Б) со сменными носиками (объемы менее 1 мл). Автоматические дозаторы бывают в свою очередь с механическим или электронным управлением. Забор и дозирование жидкостей серологическими пипетками осуществляется специальным электрическим ручным насосом (В). Для работы под ламинаром выделяют отдельный серологический насос и набор автоматических дозаторов, которые будут использоваться только под ламинаром, и находиться в нем стационарно. Для работы с автоматическими пипетками используют стерильные носики для автоматических пипеток. Наконечники дозаторов одноразовые и повторно не используются.
Дозирующие приспособления. Для дозирования жидкостей (объемы от 1 мл) обычно используют стерильные серологические пипетки однократного использования (А) и автоматические дозаторы (Б) со сменными носиками (объемы менее 1 мл). Автоматические дозаторы бывают в свою очередь с механическим или электронным управлением. Забор и дозирование жидкостей серологическими пипетками осуществляется специальным электрическим ручным насосом (В). Для работы под ламинаром выделяют отдельный серологический насос и набор автоматических дозаторов, которые будут использоваться только под ламинаром, и находиться в нем стационарно. Для работы с автоматическими пипетками используют стерильные носики для автоматических пипеток. Наконечники дозаторов одноразовые и повторно не используются.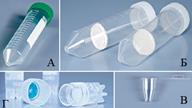 Пробирки общего и спецназначения. Можно выделить 4 типа пробирок, которые при культивировании клеток используются наиболее часто. 1-й тип – центрифужные конические пробирки (А) – используются для центрифугирования, например суспензии клеток, с целью отбора клеточного материала и т.д. Коническое дно изготавливается для удобства отбора при малом количестве осадка. 2-й тип – модифицированные конические центрифужные пробирки с встроенным фильтром. В зависимости от пористости фильтра используют для разделения элементов крови, получение клеточного материала при фильтрации суспензий клеток, концентрировании белковых растворов и т.д. Следует обращать внимание на пористость фильтра и его материал, из которого он сделан, соответствует ли он поставленной задаче (способность сорбировать белки, устойчивость к используемым реагентам и т.д.). 3-й тип – микропробирки – используют для пробоподготовки и хранения доз веществ, используемых в сверхмалой концентрации или количестве (факторы роста, например), а также центрифугировании малых объемов. Прежде чем работать с этими тремя типами пробирок, следует узнать пределы нагрузок, выдерживаемые пробирками при центрифугировании. 4-й тип – криопробирки (Г). Используются для замораживания и хранения клеток при температуре жидкого азота.
Пробирки общего и спецназначения. Можно выделить 4 типа пробирок, которые при культивировании клеток используются наиболее часто. 1-й тип – центрифужные конические пробирки (А) – используются для центрифугирования, например суспензии клеток, с целью отбора клеточного материала и т.д. Коническое дно изготавливается для удобства отбора при малом количестве осадка. 2-й тип – модифицированные конические центрифужные пробирки с встроенным фильтром. В зависимости от пористости фильтра используют для разделения элементов крови, получение клеточного материала при фильтрации суспензий клеток, концентрировании белковых растворов и т.д. Следует обращать внимание на пористость фильтра и его материал, из которого он сделан, соответствует ли он поставленной задаче (способность сорбировать белки, устойчивость к используемым реагентам и т.д.). 3-й тип – микропробирки – используют для пробоподготовки и хранения доз веществ, используемых в сверхмалой концентрации или количестве (факторы роста, например), а также центрифугировании малых объемов. Прежде чем работать с этими тремя типами пробирок, следует узнать пределы нагрузок, выдерживаемые пробирками при центрифугировании. 4-й тип – криопробирки (Г). Используются для замораживания и хранения клеток при температуре жидкого азота. политетрафторэтилен, стекловолокно. Каждый из этих материалов рассчитан на определенное применение. Так например, ацетат целлюлозы обладает очень низкой степенью адсорбции белков, а полиэфирсульфон, напротив, высокой степенью адсорбции белков. Поэтому первый материал подходит для стерильной фильтрации белковых растворов, второй – нет. Кроме того, нужно знать диапазон pH и температуры, при котором материал фильтра сохраняет структурную целостность, а также гидрофобен ли материал фильтра, или гидрофилен.
политетрафторэтилен, стекловолокно. Каждый из этих материалов рассчитан на определенное применение. Так например, ацетат целлюлозы обладает очень низкой степенью адсорбции белков, а полиэфирсульфон, напротив, высокой степенью адсорбции белков. Поэтому первый материал подходит для стерильной фильтрации белковых растворов, второй – нет. Кроме того, нужно знать диапазон pH и температуры, при котором материал фильтра сохраняет структурную целостность, а также гидрофобен ли материал фильтра, или гидрофилен.
 Камера для подсчета клеток. Предназначена для подсчета клеток в суспензии под микроскопом в проходящем свете в ручном режиме (исследователем) или в автоматическом режиме (прибором-цитометром). Камеры для использования в ручном режиме обычно содержат от 1 до 4-х рабочих полей для подсчета. Камеры для автоматических цитометров содержат обычно одно рабочее поле.
Камера для подсчета клеток. Предназначена для подсчета клеток в суспензии под микроскопом в проходящем свете в ручном режиме (исследователем) или в автоматическом режиме (прибором-цитометром). Камеры для использования в ручном режиме обычно содержат от 1 до 4-х рабочих полей для подсчета. Камеры для автоматических цитометров содержат обычно одно рабочее поле.


