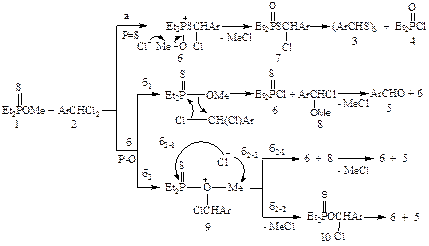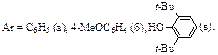ВЗАИМОДЕЙСТВИЕ АРИЛИДЕНХЛОРИДОВ С О-МЕТИЛДИЭТИЛТИОФОСФИНАТОМ
Валиева Г.Д.,1 Багаува Л.Р.2,Хайруллина О.Д.3 1 Казанский национальный исследовательский технологический университет, Казань, Россия. Молодой учёный. gulnara.chemist@mail.ru 2 Казанский национальный исследовательский технологический университет, Казань, Россия. Молодой учёный. 3 Казанский национальный исследовательский технологический университет, Казань, Россия. Молодой учёный. Научный руководитель: Газизов М.Б.
Реакция метиловых эфиров кислот P(IV) с арилиденхлоридами приводит к ароматическим альдегидами и хлориду кислот P(IV). Последний, взаимодействуя с исходными эфиром, образует ациклический или циклический ангидрид кислоты P(IV) [1]. Эфиры кислот P(IV) относятся к амбидентным нуклеофилам – фосфорильный и эфирный атомы кислорода являются электродонорными центрами. Однако при написании схемы реакции не удается дифференцировать эти атомы кислорода по первичной атаке на метиновый углерод арилиденхлорида. Мы предположили, что введение атома серы вместо одного из двух атомов кислорода даст возможность определить, какой из нуклеофильных центров будет участвовать в первичной атаке метинового углерода арилиденхлорида. От этого будет зависеть природа маршрута реакции и строение конечных продуктов. Нами впервые изучалось взаимодействие О-метилдиэтилтиофосфината (1) с арилиденхлоридами (2). При атаке тионной серой (P=S) возможно образование тримера арентиокарбальдегида (3) и диэтилхлорфосфината (4) (маршрут а), а при атаке эфирным кислородом (P-O) – аренкарбальдегида (5) и диэтилхлорфосфината (6) (маршрут б). Маршрут (а) представляет собой непрямой лигандный обмен, протекающий через образование аддукта фосфониевой структуры (6) и элиминирование метилхллорида и приводящий к продукту (7) обмена хлора в соединении (2) на диэтилфосфинилтиогруппу (дехлородиэтилфосфинилтиоилирование). Промежуточное соединение (7), видимо, малоустойчив и при температурных условиях реакции (100-150 ºC) распадается на диэтилхлорфосфинат (4) и арентиокарбальдегид, который существует лишь в тримерной форме (3) [3]. При атаке эфирным кислородом (маршрут б) имеются две возможные альтернативы: б1 – прямое нуклеофильное замещение атома хлора на метоксил (прямой лигандный обмен), которое может осуществляться в результате синхронного четырехчленного циклического переноса электронов, основными продуктами замещения являются α-хлорэфир (8) и диэтилхлортиофосфинат (6); б2 – непрямой лигандный обмен через образование оксониевого катиона (9), который, в свою очередь может стабилизироваться двумя путями: б2-1 или б2-2. Соединение (8) неустойчиво и в условиях эксперимента распадается в аренкарбальдегид (5) и метилхлорид. Методом динамической ЯМР 1H и 31P спектроскопии было установлено, что реакция между соединениями (1) и (2) в соотношении 1:1 при 100-150 ºС завершается за 20-25 часов. Из реакционной массы с хорошими выходами выделены кристаллические продукты, представляющие собой тримеры арентиокарбальдегидов (3). Перегонкой жидкой части реакционной массы после фильтрования тримеров (3) получен диэтилхлорфосфинат (4) (δP 75 м. д.).
Таким образом, образование исключительно соединений (3) и (4) при взаимодействии эфира (1) с гем -дихлоридом (2) свидетельствует о первичной атаке тиофосфорильной группой метинового углерода, т.е. о реализации маршрута (а) реакции. Из литературы известно, что тримеры арентиокарбальдегидов имеют: α-, β- и γ-формы. Первые две формы являются разными стереоизомерами индивидуальных тримеров. γ-Форма представляет собой эвтектическую смесь α- и β-форм. Температуры плавления, данные спектров ЯМР 1H свидетельствуют о том, что синтезированные тримеры (3а-в) представляют β-форму. Согласно данным спектров ЯМР 1H тримеров арентиокарбальдегидов (3) [2] в β-форме тритиановый цикл имеет конформацию кресло, все три атома водорода метиновых групп занимают аксиальное положение, а арильные группы экваториальные положения.
Литература: [1] Газизов М.Б.,Качалова Т.Н.,. Каримова Р.Ф, Хайруллин Р.А., Синяшин О.Г. Ж. Общ. Хим. 67, 2055-2056 (1997). [2] Campaigne E., Chamberlain N.F., Edwards B.N. J. Org. Chem. 27, 135-138 (1962).
|