Растворы электролитов. Движение ионов в электрическом поле
Закон разбавления Оствальда для электролита, диссоциирующего на два иона Кд= где Кд – константа диссоциации электролита; С – молярная концентрация; α; – степень диссоциации. Если для слабого электролита выполняется условие α;<<1, то справедливо приближенное равенство
Связь между изотоническим коэффициентом и степенью диссоциации электролита
где α; – степень диссоциации; i – изотонический коэффициент; n – число ионов, на которые распадается электролит.
Молярная активность
где С – молярная концентрация. Активность электролита АmBn a=a+m × a-n. (2.5.4)
Средняя активность ионов электролита АmBn
Средний коэффициент активности ионов электролита АmBn
Ионная сила раствора
где Сi – концентрации всех находящихся в растворе ионов (для точных расчетов нужно подставлять моляльные концентрации, но в разбавленных растворах без существенной погрешности их можно заменить молярными концентрациями); zi – заряды всех находящихся в растворе ионов.
Уравнение Дебая-Гюккеля
где I – ионная сила раствора; z1 и z2 – заряды ионов.
Подвижность (абсолютная скорость движения) ионов
где Е – напряженность электрического поля, В/м Числа переноса ионов
Электрическое сопротивление
где l – расстояние между электродами, м; S – площадь электродов, м2
Удельная электрическая проводимость раствора (удельная электропроводность)
Молярная эквивалентная электропроводность
где Сэкв. – эквивалентная (нормальная) концентрация электролита, моль экв./м3;
Степень диссоциации
где
Закон Кольрауша (закон независимого движения ионов)
Так как
формула (2.5.15) преобразуется к виду
где F – постоянная Фарадея (96500 Кл/моль).
|

 ,(2.5.1)
,(2.5.1) .
. , (2.5.2)
, (2.5.2) , (2.5.3)
, (2.5.3) – молярный коэффициент активности;
– молярный коэффициент активности; . (2.5.5)
. (2.5.5)
 . (2.5.6)
. (2.5.6) , (2.5.7)
, (2.5.7) , (2.5.8)
, (2.5.8) – средний коэффициент активности ионов;
– средний коэффициент активности ионов; , (2.5.9)
, (2.5.9) – скорость движения иона, м/с;
– скорость движения иона, м/с;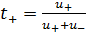 ;
;  (2.5.10)
(2.5.10) , (2.5.11)
, (2.5.11) – удельное сопротивление, Ом·м;
– удельное сопротивление, Ом·м; ;
;  (2.5.12)
(2.5.12) ;
;  (2.5.13)
(2.5.13) – объем раствора, содержащий 1 моль экв. электролита (разбавление или разведение), м3
– объем раствора, содержащий 1 моль экв. электролита (разбавление или разведение), м3 , (2.5.14)
, (2.5.14) - эквивалентная электропроводность при бесконечном разбавлении.
- эквивалентная электропроводность при бесконечном разбавлении. (2.5.15)
(2.5.15) ;
;  ,
, , (2.5.16)
, (2.5.16)


