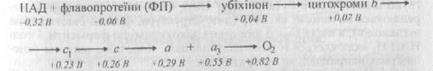Редокс-ланцюг|цеп| окислювального фосфорилювання.
Електрони переносяться з|із| НАДН| на кисень за допомогою трьох великих ферментних комплексів дихального ланцюга|цепу|. Хоча механізми витягання|видобування| енергії в дихальному ланцюзі|цепі| і в інших катаболічних реакціях різні, в їх основі лежать загальні|спільні| принципи. Реакція Н2 + 1/2 О2 ® Н2О розбита на багато невеликих «кроків», так що енергія, що вивільняється, може переходити у зв'язані| форми, а не розсіюватись у вигляді тепла. Як і у разі|в разі| утворення АТФ| і НАДH при гліколізі або в циклі лимонної кислоти, це зв'язано з використанням непрямого шляху|колії,дороги|. Але|та| унікальність дихального ланцюга|цепу| полягає в тому, що тут перш за все|передусім| атоми водню розщеплюються на електрони і протони. Електрони передаються через серію переносників, вбудованих у внутрішню мітохондріальну мембрану. Коли електрони досягають кінця цього електронтранспортного| ланцюга|цепу|, протони виявляються|опиняються| там же для нейтралізації негативного|заперечного| заряду, що виникає під час переходу електронів на молекулу кисню. Прослідкуємо|прослідимо| процес окислення, починаючи|розпочинаючи,зачинаючи| з|із| утворення НАДH - головного акцептора реактивних електронів, віжщеплених при окисненні молекул поживних|живлячих,поживних| речовин. Кожен атом водню складається з одного електрона і одного протона. Кожна молекула НАДH несе гідрид-іон (водневий| атом + додатковий електрон, Н:-), а не просто атом водню. Проте|однак| із-за присутності в навколишньому|довколишньому| водному розчині вільних протонів перенесення|перенос| іона гідриду у складі НАДH еквіва| лентне| перенесенню|переносу| двох атомів водню або молекули водню (Н:- + Н+ ® Н2). Перенесення|перенос| електронів по дихальному ланцюгу|цепу| починається з відняття|видалення| іона (Н:-) гідриду від НАДH; при цьому регенерується НАД+, а гідрид-іон перетворюється на протон і два електрони (Н:- ® Н+ + 2е-). Ці електрони переходять на перший із понад 15 різних переносників електронів в дихальному ланцюзі|цепі|. У цей момент електрони володіють дуже великою енергією, запас якої поступово зменшується у міру проходження їх по ланцюгу|цепу|. Найчастіше електрони переходять від одного атома металу до іншого, причому кожний з цих атомів міцно пов'язаний з білковою молекулою, яка впливає на його спорідненість до електрона. Важливо|поважно| відзначити, що всі білки – переносники електронів – групуються в три великі комплекси дихальних ферментів, кожний з яких містить|утримує| трансмембранні| білки, що міцно закріплюють комплекс у внутрішній мембрані мітохондрії. Кожен подальший|наступний| комплекс володіє великою спорідненістю до електронів, чим попередній. Електрони послідовно переходять з одного комплексу на іншій, поки|доки| нарешті|урешті| не перейдуть на кисень, що має найбільшу спорідненість до електрона. Енергія, що вивільняється в процесі перенесення|переносу| електронів по дихальному ланцюгу|цепу|, запасається у формі електрохімічного протонного градієнта на внутрішній мембрані мітохондрій. Окислювальне фосфорилювання можливе завдяки тісній асоціації переносників електронів з|із| білковими молекулами. Білки направляють|спрямовують,скеровують| електрони по дихальному ланцюгу|цепу| так, що вони последо|вно| переходять від одного ферментного комплексу до іншого, не «перескакуючи» через проміжні ланки. Особливо важливо|поважно| те, що перенесення|перенос| електронів зв'язане з|із| аллостерічними| змінами певних білків молекул, внаслідок чого енергетично вигідний потік електронів викликає|спричиняє| перекачування протонів (Н+) через внутрішню мем6рану з|із| матриксу в міжмембранний простір і далі за межі мітохондрії. Пересування протонів приводить|призводить,наводить| до двох важливих|поважних| наслідків: 1) між двома сторонами внутрішньої мембрани створюється градієнт рН| - в матриксі рН| вище, ніж в цитозоле|, де значення рН| звичайно близьке до 7,0 (оскільки|тому що| малі молекули вільно проходять через зовнішню мембрану мітохондрії, рН| в міжмембранному просторі буде таким же як в цитозоле|); 2) на внутрішній мембрані створюється градієнт напруги|напруження| (мембранний потенціал), причому внутрішня сторона мембрани заряджена негативно|заперечний|, а зовнішня - позитивно. Градієнт рН| (DрН|) примушує|заставляє| іони Н+ переходити назад в матрикс, а іони ОН-| з|із| матриксу, що підсилює|посилює| ефект мембранного потенціалу, під дією якого будь-який позитивний заряд притягується в матрикс, а будь-який негативний|заперечний| виштовхується з|із| нього. Сумісна|спільна| дія цих двох сил приводить|призводить,наводить| до виникнення електрохімічного протонного градієнта. Електорохимічеській протонний градієнт створює протонорушійну| силу, вимірювану в міллівольтах| (мВ|). Енергія електрохімічного протонного градієнта використовується для синтезу АТФ| і транспорту метаболітов| і неорганічних іонів в матрикс. Внутрішня мембрана мітохондрій відрізняється незвично високим змістом|вмістом,утриманням| білка - в ній по вазі приблизно 70% білка і 30%фосфолипидов. Багато хто з|із| цих білків входить до складу електронтранспортного| ланцюга|цепу|, що підтримує протонний градієнт на мембрані. Інший важливий|поважний| компонент - фермент АТФ-синтетаза, що каталізує синтез АТФ|. Це великий білковий комплекс, через який протони перетікають назад в матрикс по електрохімічному градієнту. Подібно турбіні, АТФ-синтетаза перетворить одну форму енергії в іншу, синтезуючи АТФ| з|із| AДФ і Фн в мітохондріальному матриксі в ході реакції, зв'язаної із|із| струмом|током| протонів в матрикс. | Але|та| синтез АТФ| - це не єдиний процес, що йде за рахунок енергії електрохімічного градієнта. У матриксі, де знаходяться|перебувають| ферменти, що беруть участь в циклі лимонної кислоти і інших мета|болічних| реакціях, необхідно підтримувати високі концентрації різних субстратів; зокрема, для АТФ-синтетази потрібні AДФ і фосфат. Тому через внутрішню мембрану повинні транспортуватися різноманітні|всілякі| несучі заряд субстрати. Це досягається за допомогою різних білків-переносників, вбудованих в мембрану, багато хто з|із| яких активно перекачує певні молекули проти|супроти| їх електрохімічних градієнтів, тобто здійснюють процес, що вимагає витрати|затрати| енергії. Для більшої частини|частки| метаболітів| джерелом цієї енергії, служить сполучення|спряження| з|із| переміщенням якихось інших молекул «вниз» по їх електрохімічному градієнту. Наприклад, в транспорті АДФ| бере участь система антипорту АДФ-АТФ|: під час переходу кожної молекули AДФ в матрикс з|із| нього виходить по своєму електрохімічному градієнту одна молекула АТФ|. В той же час система симпорта| сполучає перехід фосфату всередину мітохондрії з|із| направленим|спрямованим| туди ж потоком Н+: протони входять в матрикс по своєму градієнту і при цьому “тягнуть” за собою фосфат. Подібні образом|зображенням| переноситься в матрикс і піруват|. Енергія електрохімічного протонного градієнта використовується також для перенесення|переносу| в матрикс іонів Са2+, які, мабуть|очевидно|, виконують важливу|поважну| роль в регуляції активності деяких мітохондріальних ферментів. Чим більше енергії електрохімічного градієнта витрачається на перенесення|перенос| молекул і іонів в мітохондрію, тим менше залишається для синтезу АТФ|. Наприклад, якщо ізольовані мітохондрії помістити в середу з|із| високим змістом|вмістом,утриманням| Са2 +, то вони повністю припинять синтез АТФ|; вся енергія градієнта витрачатиметься на транспорт Ca2+ в матрікс|. У деяких спеціалізованих клітинах|клітинах| електрохімічний протонний градієнт «шунтується» таким чином, що мітохондрії замість синтезу АТФ| утворюють тепло. Очевидно, клітки|клітини| здатні|здібні| регулювати використання енергії електрохімічного протонного градієнта і направляти|спрямовувати,скеровувати| її на ті процеси, які найбільш важливі|поважні| в даний момент. Швидке перетворення АДФ| в АТФ| в мітохондріях дозволяє підтримувати високе відношення|ставлення| концентрацій ATФ/AДФ в клітках|клітинах|. За допомогою особливого білка, вбудованого у внутрішню мембрану, AДФ транспортується в матрикс в обмін на АТФ| за принципом антипорту. В результаті|унаслідок,внаслідок| молекули AДФ, що вивільняються при гідролізі АТФ| в цитозолі|, швидко поступають в мітохондрію для «перезарядки», тоді як молекули АТФ|, що утворюються в матриксі в процесі окислювального фосфорилювання, теж|також| швидко виходять в цитозоль|, де вони потрібні. В процесі окислювального фосфорилування кожна пара електронів НАДH забезпечує енергією утворення|утворення| трьох молекул АТФ|. Пара електронів ФАДH2, що володіє меншою енергією, дає енергію для синтезу тільки|лише| двох молекул АТФ|. В середньому кожна молекула ацетіл-СоА| що поступає в цикл лимонної кислоти, дає близько 12 молекул АТФ|. Це означає, що при окисленні однієї молекули глюкози утворюються 24 молекули АТФ|, а при окисленні однієї молекули пальмітата| - жирної кислоти з|із| 16 вуглецевими атомами - 96 молекул АТФ|. Якщо врахувати також екзотермічні реакції, що призводять до| утворення ацетіл-СоА|, то виясняється, що повне|цілковите| окислення однієї молекули глюкози дає близько 36 молекул АТФ|, тоді як при повному|цілковитому| окисленні пальмітата| утворюється приблизно 129 молекул АТФ|. Це максимальні величини, оскільки|тому що| фактично кількість того, що синтезується в мітохондріях АТФ| залежить від того, яка частка|доля| енергії протонного градієнта йде на синтез АТФ|, а не на інші процеси. Якщо порівняти| зміну вільної енергії при згоранні|згорянні| жирів і вуглеводів прямо до СО2 і Н2О із|із| загальною|спільною| кількістю енергії, що запасається у фосфатних зв'язках АТФ| в процесах біологічного окислення, опиниться, що ефективність перетворення енергії окислення в енергію АТФ| часто перевищує 50%. Оскільки вся невикористана енергія вивільняється у вигляді тепла, великі|великі| організми потребували б ефективніших способів відведення тепла в навколишнє середовище. Величезна кількість вільної енергії, що вивільняється при окисленні, може ефективно використовуватися тільки|лише| дрібними|мілкими| порціями. У складному процесі окислення бере участь багато проміжних продуктів, кожний з яких лише | несуттєво| відрізняється від попереднього. завдяки цьому енергія, що вивільняється, поділяється на менші кількості, які можна ефективно перетворювати за допомогою зв'язаних реакцій у високоенергетичні|| зв'язки молекул АТФ| і НАДH. У 1960 р. було вперше|уперше| показано, що різні мембранні білки, що беруть участь в окислювальному фосфорилуванні, можуть бути ви ділені| без втрати активності. Від поверхні субмітохондріальних частинок|часток,часточок| вдалося відокремити|відділити| і перевести|перекласти,переказати| в розчинну форму усі|засіюючі| їх білкові структури. Хоча субмітохондріальні частинки|частки,часточки| без цих сферичних структур продовжували окисляти|окислювати| НАДH у присутності кисню, синтезу АТФ| при цьому не відбувалося|походило|. З іншого боку, виділені структури діяли як АТФази, гідролізує АТФ| до АДФ| і Фн. Коли сферичні структури (названі|накликати| F1-АТФазами) додавали|добавляли| до позбавлених їх субмітохондріальних частинок|часток,часточок|, реконструйовані частинки|частки,часточки| знов|знову,щойно| синтезували АТФ| з|із| AДФ і Фн. F1- АТФаза - це частина|частка| великого, пронизливого всю товщу мембрани комплексу, який складається щонайменше з дев'яти різних поліпептідних| ланцюгів|цепів|. Цей комплекс одержав|отримав,набув| назву АТФ-синтетаза; він складає близько 15% всього білка внутрішньо мітохондріальної| мембрани. Вельми|дуже| схожі АТФ-синтетази є|наявний| в мембранах хлоропластів і бактерій. Такий білковий комплекс містить|утримує| трансмембранні| канали для протонів, і відбувається|походить| тільки|лише| тоді, коли через ці канали проходять протони вниз по своєму електрохімічному градієнту. АТФ-синтетаза може діяти у зворотному напрямі - розщеплювати АТФ| і перекачувати протони. Дія АТФ-синтетази оборотно: вона здатна|здібна| використовувати як енергію гідролізу АТФ| для перекачування протонів через внутрішню мітохондріальну мембрану, так і енергію потоку протонів по електрохімічному градієнту для синтезу АТФ|. Таким чином, АТФ-синтетаза - це оборотна сполучаюча система, яка здійснює взаємоперетворення енергії електрохімічного протонного градієнта і хімічних зв'язків. Напрям|направлення| її роботи залежить від співвідношення між крутизною|крутістю| протонного градієнта і локальною величиною G для гідролізу АТФ|. АТФ-синтетаза одержала|отримала,набула| свою назву у зв'язку з тим, що в звичайних|звичних| умовах npoтоннoro градієнта, підтримуваного дихальним ланцюгом|цепом|, синтезує велику частину|частку| всього АТФ| клітини|клітини|. Число протонів, необхідне для синтезу однієї молекули АТФ|, в точності не відомо. При проходженні через АТФ-синтетазу протонів синтезується одна молекула АТФ|. Як працюватиме в даний момент АТФ-синтетаза - у напрямі синтезу або гідролізу АТФ|, - залежить від точного балансу між змінами вільної енергії для проходження трьох протонів через мембрану в матрикс і для синтезу АТФ| в матриксі. Як вже мовилося, величина Gсинт.АТФ визначається концентраціями трьох речовин в матриксі мітохондрії - АТФ|, AДФ і Фн. При постійній протонрушійній| силі АТФ-синтетаза синтезуватиме ATФ тих пір, поки|доки| відношення|ставлення| АТФ| до AДФ і Фн не досягне такого значення, при якому величина Gсинт.АТФ стане в точності рівна +15,2ккaл/мoль. За таких умов синтез АТФ| буде точний врівноважуватися|зрівноважуватися,урівноважуватися| його гідролізом. Припустимо|передбачимо|, що у зв'язку з реакціями, що вимагають витрати|затрати| енергії, в цитозоле| раптово гидролізовалось| велика кількість АТФ|, і це привело до падіння відношення|ставлення| АТФ:AДФ в матриксі мітохондрії. В цьому випадку Gсинт. знизиться і АТФ-синтетаза знов|знову,щойно| перемкнеться на синтез АТФ|, поки|доки| не | відновиться| початкове|вихідне| відношення|ставлення| АТФ:AДФ. Якщо ж протонорушійна| сила раптово знизиться і підтримуватиметься на постійному рівні, то АТФ-синтетаза почне|розпочне,зачне| розщеплювати АТФ|, і ця реакція продовжуватиметься|триватиме| до тих пір, поки співвідношення між концентраціями ATФ і AДФ не досягне якогось нового значення (при якому Gсинт.АТФ = +13,8 ккал/моль), і так далі. Якщо АТФ-синтетаза в нормі не транспортує Н+ з|із| матриксу, то дихальний ланцюг|цеп|, що знаходиться|перебуває| у внутрішній мітохондріальній мембрані, за нормальних умов переносить через цю мембрану протони, створюючи таким чином електрохімічний протонний гра|дієнт|, що доставляє енергію, для синтезу AТФ. Більшість переносників електронів, що входять до складу дихального ланцюга|цепу|, поглинають світло, і їх окислення або відновлення супроводжується|супроводиться| зміною кольору|цвіту|. Звичайно спектр поглинання і реакцийноздатність| кожного переносника достатньо|досить| характерні|вдача|, що дозволяє навіть в неочищеному екстракті простежувати|просліджувати| зміни його станів за допомогою спектроскопії. Це дало можливість|спроможність| виділити такі переносники задовго до того, як стала зрозуміла їх істинна функція. Наприклад, цитохроми| були відкриті|відчинені| в 1925 р. як утворення|сполучення,сполуки|, які швидко окислюються|окисляються| і відновлюються у|в,біля| таких різних організмів, як дріжджі, бактерії і комахи. Спостерігаючи клітки|клітини| і тканини за допомогою спектроскопа, вдалося ідентифікувати три типу цитохромів|, які розрізнялися по спектрах поглинання і названі|накликати| цитохромамі| а, b і с|із|. Клітини|клітини| містять|утримують| декілька видів цитохромів| кожного типу, і класифікація по типах не відображає|відбиває| їх функцію. Найпростішим переносником електронів є убіхиноном| або коферментом| Q. Він здатний|здібний| прийняти або віддати як один, так і два електрони і тимчасово захоплює|захвачує| з|із| середовища|середи| протон при перенесенні|переносі| кожного електрона. Дихальний ланцюг|цеп| містить|утримує| три великі ферментні комплекси, вбудовані у внутрішню мембрану. Мембранні білки важко|скрутно| виділити у вигляді інтактних| комплексів, оскільки|тому що| вони нерастворіми| в більшості водних розчинів, а такі речовини, як детергенти| і сечовина, необхідні для їх солюбілізациі|, можуть порушувати нормальну белок-белковоє| взаємодію. Проте|однак| на початку 1960-х рр. було виявлено, що за допомогою відносно м'яких іонних детергентов|, таких як дезоксихолат|, можна солюбілізіровать| деякі компоненти мітохондріальної внутрішньої мембрани в натівной| формі. Це дозволило ідентифікувати і виділити три головних пов'язаних з мембраною комплексу дихальних ферментів на шляху|колії,дорозі| від НАДH до кисню.
1. НАДН-дегидрогеназний комплекс - найбільший з|із| дихальних ферментних комплексів - має молекулярну масу понад 800000 і містить|утримує| більше 22 поліпептідних| ланцюгів|цепів|. Він приймає електрони від НАДH і передає їх через флавін і щонайменше п'ять железо-серних| центрів на_ убіхинон| - невелику жиророзчинну молекулу, передаюшую| електрони на другий комплекс дихальних ферментів-комплекс b-c1. 2. Комплекс b-с1 складається щонайменше з 8 різних поліпептідних| ланцюгів|цепів| і, ймовірно|певно,мабуть|, існує у вигляді дімера| з|із| молекулярною масою 500000. Кожен мономер містить|утримує| три тема, пов'язаних з цитохромамі|, і железо-серний| білок. Комплекс приймає електрони від убіхинона| і передає цитохрому| з|із|, невеликому периферичному мембранному білку, який потім переносить їх на цитохром-оксидазний| комплекс. 3.Цитохромоксидазный комплекс (цитохром| а-а3) - найбільш вивчений | з|із| трьох комплексів. Він складається не менше ніж з восьми різних поліпептідних| ланцюгів|цепів| і виділений як дімер з| молекулярною масою 300000; кожен мономер містить|утримує| два цитохрома| і два атоми меди.этот комплекс приймає електрони від цитохрома| з|із| і передає їх на кисень. Цитохроми|, ферум-сульфурні центри і атоми міді здатні|здібні| переносить одночасно тільки|лише| один електрон. Тим часом, кожна молекула НАДН| віддає два електрони і кожну молекулу О2 повинна прийняти 4 електрони при утворенні молекули води. У електронтранспортной| ланцюзі|цепі| є|наявний| декілька електронсобірающих| і електронраспределяющих| ділянок, де узгоджується різниця в числі електронів. Так, наприклад, цитохромоксидазний| комплекс приймає від молекул цитохрома| з|із| окремо 4 електрони і зрештою|врешті решт| передає їх на одну зв'язану молекулу О2, що веде до утворення двох молекул води. На проміжних ступенях|рівнях| цього процесу два електрони, перш ніж перейти до ділянки, що зв'язує кисень, поступають в гем| цитохрома| а, і пов'язаний з білком атом міді, Cua. У свою чергу ділянка скріплення|зв'язування| кисню містить|утримує| ще один атом міді і гем| цитохрома| а3. Проте|однак| механізм утворення двох молекул води в результаті|унаслідок,внаслідок| взаємодії зв'язаної молекули О2 з|із| чотирма протонами в точності не відомий. У більшості кліток|клітин| з|із| цитохромоксидазой| взаємодіє близько 90% всього кисню, що поглинається. Токсичність таких отрут, як ціанид|ціанід| і азид, пов'язані з їх здатністю|здібністю| міцно приєднуватися до цитохромоксидазному| комплексу і блокувати тим самим весь транспорт електронів. Два компоненти, що переносять електрони між трьома головними ферментними комплексами дихального ланцюга|цепу|, - убіхинон| і цитохром| з|із| – швидко переміщаються шляхом дифузії в площині|плоскості| мембран. Зіткнення|сутички| між цими рухомими|жвавими,рухливими| переносниками і ферментними комплексами цілком|сповна| дозволяють пояснити спостережувану | швмдкість| перенесення|переносу| електронів (кожен комплекс віддає і приймає один електрон кожні 5-10 мілісекунд). Тому немає необхідності припускати|передбачати| структурну впорядкованість ланцюга|цепу| білків-переносників в ліпідному біслоє|; насправді|дійсно|, ферментні комплекси, мабуть|певне| існують в мембрані як незалежні компоненти і впорядковане перенесення|перенос| електронів забезпечується тільки|лише| специфічністю функціональних взаємодій між компонентами ланцюга|цепу|. На користь цього говорить і той факт, що різні компоненти дихального ланцюга|цепу| присутні в абсолютно|цілком| різних кількостях. Наприклад, в мітохондріях серця на кожну молекулу НАДН-дегидрогеназного комплексу доводяться|припадають,приходяться| З молекули комплексу b-c1 комплексу, 7 молекул цитохромоксидазного| комплексу, 9 молекул цитохрому| з|із| і 50 молекул убіхинону|; вельми|дуже| різні співвідношення цих білків виявлені і в деяких інших клітках|клітинах|. Значний перепад окислювально-відновного потенціалу на кожному з трьох комплексів дихального ланцюга|цепу| доставляє енергію, необхідну для перекачування протонів. Таку пару, як Н2О і ЅО2 (або НАДH і НАД+), називають зв'язаною окислювально-відновною парою, оскільки|тому що| один з її членів перетворюється в іншій, якщо додати|добавити| один або декілька електронів і один або декілька протонів (останніх завжди доста|тнье в будь-якому водному розчині). Так, наприклад ЅО2 + 2е + 2Н+ ® Н2О Добре відомо, що суміш з'єднань|сполучень,сполук|, створюючих зв'язану кислотно-лужну пару, в співвідношенні 50:50 діє як буфер, що підтримує певний «тиск|тиснення| протонів» (рН|), величина якого визначається константою дисоціації кислоти. Таким самим чином суміш компонентів пари в співвідношенні 50:50 підтримує певний «тиск|тиснення| електронів», або окислювально-відновний потенціал (редокс-потенціал) Е, службовець мірою спорідненості молекули-переносника до електронів. Поміщаючи електроди в розчин з|із| відповідними окислювально-відновними парами, можна зміряти|виміряти| редокс-потенціал кожного переносника електронів, що бере участь в біологічних окислювально-відновних реакціях. Пари з'єднань|сполучень,сполук| з|із| найбільш негативними|заперечними| значеннями редокс-потенціалу володіють найменшою спорідненістю до електронів, тобто містять|утримують| переносники з|із| найменшою тенденцією приймати електрони і найбільшою тенденцією їх віддавати. Наприклад, суміш НАДH і НАД+ (50:50) має редокс-потенціал -320 мВ|, що указує|вказує| на сильно виражену|виказану,висловлену| здатність|здібність| НАДH віддавати електрони, тоді як редокс-потенціал суміші рівних до лічеств| Н2О і ЅО2 складає +820 мВ|, що означає сильну тенденцію 02 до ухвалення|прийняття,приймання| електронів. Різкий перепад має місце в межах кожного з трьох головних дихальних комлексов|. Різниця потенціалів між любыми_двумя переносниками електронів прямо пропорційна|пропорціональна| енергії, що вивільняється під час переходу електрона від одного переносника до іншого. Кожен комплекс діє як що енергоперетворює пристрій|устрій|, направляючи|спрямовуючи,скеровувавши| цю вільну енергію на переміщення протонів через мембрану, що приводить|призводить,наводить| до створення|створіння| електрохімічного протонного градієнта у міру проходження електронів по ланцюгу|цепу|. Для роботи енергоперетворюючого механізму, лежачого в основі окислювального фосфорилування, потрібно, щоб кожен ферментний комплекс дихального ланцюга|цепу| був орієнтований у внутрішній мітохондріальній мембрані певним чином – так, щоб всі протони переміщалися в одному напрямі|направленні|, тобто з|із| матриксу назовні. Така векторна організація мембранних білків була продемонстрована за допомогою спеціальних зондів, що не проходять|минають,спливають| крізь мембрану, якими мітили|цілилися| комплекс тільки|лише| з|із| якою-небудь|будь-якою| однієї сторони мембрани. Специфічна орієнтація в бислоe властива всім мембранним білкам і дуже важлива|поважна| для їх функції. Механізми перекачування протонів компонентами дихального ланцюга|цепу|. В процесі окислювального фосфорилування при окисленні однієї молекули НАДН| (тобто при проходжень двох електронів через всі три ферментних комплексу) утворюється не більше трьох молекул АТФ|. Якщо припустити|передбачити|, що зворотне проходження трьох протонів через АТФ-синтетазу забезпечує синтез однієї молекули АТФ|, можна буде укласти, що в середньому перенесення|перенос| одного електрона кожним комплексом супроводжується|супроводиться| переміщенням півтора протонів (іншими словами, при транспорті одного електрона деякі комплекси перекачують один протон, а інші - два протони). Ймовірно|певно,мабуть|, у|в,біля| різних компонентів дихального ланцюга|цепу| існують різні механізми сполучення|спряження| транспорту електронів з|із| переміщенням протонів. Аллостерічеськіє| зміни конформації білкової молекули, пов'язані з транспортом електронів, можуть у принципі|в принципі| супроводжуватися|супроводитися| «перекачуванням» протонів, подібно тому як переміщаються протони при обігу|ставленні,звертанні| дії АТФ-синтетази. При перенесенні|переносі| кожного електрона хинон| захоплює|захвачує| з|із| водного середовища|середи| протон, який потім віддає при вивільненні електрона. Оскільки убіхинон| вільне пересувається в ліпідному біслоє|, він може приймати електрони поблизу внутрішньої поверхні мембрани і передавати їх на комплекс b-с1 біля|близько| її зовнішньої поверхні, переміщаючи при цьому через біслой| по одному протону на кожен перенесений електрон. За допомогою складніших моделей можна пояснити і переміщення комплексом b-c1 двох протонів на кожен електрон, припустивши|передбачивши|, що убіхинон| повторно проходить через комплекс b-c1 в певному напрямі|направленні|. На відміну від цього молекули, що передають електрони цитохромоксидазному| комплексу, мабуть|очевидно|, не переносять протонів, і в цьому випадку транспорт електронів, ймовірно|певно,мабуть|, пов'язаний з певною аллостерічеськім| зміною конформації білкових молекул, в результаті|унаслідок,внаслідок| якої якась частина|частка| білкового комплексу сама переносить протони. Дія роз’єднувачів|. З 40-х років відомий ряд|лава,низка| ліпофільних| слабких|слабих| кислот, здатних|здібних| діяти як роз'єднуючі агенти, тобто порушувати сполучення|спряження| транспорту електронів з|із| синтезом АТФ|. При додаванні|добавці| до кліток|клітин| цих низькомолекулярних органічних сполук мітохондрії прекраща| ют синтез АТФ|, продовжуючи при цьому поглинати кисень. У присутності роз'єднуючого агента, швидкість транспорту електронів залишається високою, але|та| протонний градієнт не створюється. Це просте пояснення цього ефекту: роз'єднуючі агенти (наприклад, дінітрофенол|, тіроксин|) діють як переносники Н+ (Н+-ионофоры) і відкривають|відчиняють| додатковий шлях|колію,дорогу| - вже не через АТФ-синтетазу – для потоку Н+ через внутрішню мітохондріальну мембрану. Дихальний контроль. Коли до кліток|клітин| додають|добавляють| роз'єднуючий агент, наприклад дінітрофенол|, поглинання кисню мітохондріями значно зростає, оскільки|тому що| швидкість перенесення|переносу| електронів збільшується. Таке прискорення пов'язане з існуванням дихального контролю. Вважають|гадають|, що цей контроль заснований на прямому інгібуючому впливі електрохімічного протонного градієнта на транспорт електронів. Коли у присутності разобщителя| електрохімічний градієнт зникає, не контрольований більш транспорт електронів досягає максимальної швидкості. Зростання градієнта пригальмовує дихальний ланцюг|цеп|, і транспорт електронів сповільнюється. Більш того|більше того|, якщо в експерименті штучно створити на внутрішній мембрані незвично високий електрохімічний градієнт, то нормальний транспорт електронів припиниться зовсім, а на деяких ділянках дихального ланцюга|цепу| можна буде виявити зворотний потік електронів. Це дозволяє перед вважати|гадати|, що дихальний контроль відображає|відбиває| простий баланс між зміною вільної енергії при переміщенні протонів, зв'язаний ного| з|із| транспортом електронів, і зміною вільної енергії при самому транспорті електронів.Величина електрохімічного градієнта впливає як на швидкість, так і на напрям|направлення| перенесення|переносу| електронів, так само як і на напрям|направлення| дії АТФ-синтетази. Дихальний контроль - це лише частина|частка| складної системи взаємозв'язаних регуляторних|регулювальник| механізмів із|із| зворотними зв'язками, коордіні| рующей| швидкості гліколізу, розщеплювання жирних кислот, реакцій циклу лимонної кислоти і транспорту електронів. Швидкості всіх цих процесів залежать від відношення|ставлення| АТФ:AДФ - вони зростають, коли це відношенням|ставленням| зменшується в результаті|унаслідок,внаслідок| посиленого використання АТФ|. Наприклад, АТФ-синтетаза внутрішньої мітохондріальної мембрани працює швидше, коли концентрації її субстратів, тобто.AДФ і Фн, збільшуються. Чим вища швидкість цієї реакції, тим більше протонів перетікає в матрикс, швидше розсіюючи тим самим електрохімічний градієнт; а зменшення градієнта в свою чергу приводить|призводить,наводить| до прискорення транспорту електронів. Мітохондрії бурої жирової тканини – генератори тепла. Всім хребетним|хребцевим| у молодому віці для утворення тепла, на додаток до механізму м'язового тремора, необхідний термогенноє| пристрій|устрій|. Такого роду пристрій|устрій| особливо важливий|поважний| для тварин, що впадають в зимівлю. М'язи в стані тремора скорочуються і за відсутності навантаження, використовуючи скоротливі|скорочувальні| білки для гідролізу АТФ| звичайним|звичним| для м'язових кліток|клітин| чином і звільняючи|визволяючи| у вигляді тепла всю енергію, потенційно доступну при гідролізі АТФ|. Необхідність особливого термогенного| пристрою|устрою| визначається міцно зв'язаним окислювальним фосфорилуванням нормальних мітохондрій. Якби цей процес міг бути роз'єднаний, як це буває у присутності дінітрофенола|, він міг би служити як адекватне пристосування, що виробляє|справляє,проводить| тепло; саме так це відбувається|походить| в мітохондріях бурого жиру. Хоча ці мітохондрій володіють звичайними|звичними| оборотними АТФазой, в них є|наявний| також трансмембранная| протонна транслоказа|, за допомогою якої протони можуть повертатися в матрикс і електрично шунтувати роботу АТФази. Якщо цей процес достатній для того, щоб підтримувати окислювально-відновний потенціал водню значно нижче 200 мВ|, синтез АТФ| стає неможливим і окислювальний процес протікає вільно, внаслідок чого вся енергія звільняється|визволяється| у вигляді тепла.
Цикл лимонної кислоти (цикл трікарбонових| кислот, цикл Кребса) Цикл лимонної кислоти є серію реакцій, що протікають в мітохондріях, в ході яких здійснюється катаболізм ацетилових груп і вивільнення водневих еквівалентів; при окисленні останніх поставляється вільна енергія паливних ресурсів тканин. Ацетилові групи знаходяться|перебувають| у складі ацетіл-КоА| (активного ацетату), тіоефіру кофермента| А. Головна функція циклу лимонної кислоти полягає в тому, що він є|з'являється,являється| загальним|спільним| кінцевим|скінченним| шляхом|колією,дорогою| окислення вуглеводів, білків і жирів, оскільки в ході метаболізму глюкоза, жирні кислоти і амінокислоти перетворюються або в ацетіл-СоА|, або в проміжні з'єднання|сполучення,сполуки| циклу. Цикл лимонної кислоти виконує також головну роль в процесах глюконеогенеза|, переамінірованія|, дезамінірованія| і ліпогенезу, Хоча ряд|лава,низка| цих процесів протікає в багатьох тканинах, печінка - єдиний орган, в якому йдуть всі перераховані процеси. Тому серйозні наслідки|результати| викликає|спричиняє| пошкодження|ушкодження| великого числа кліток|клітин| печінки або заміщення їх сполучною тканиною. Про життєво важливу|поважну| роль циклу лимонної кислоти свідчить і той факт, що у|в,біля| людини майже не відомі генетичні зміни ферментів, що каталізують реакції циклу, оскільки|тому що| наявність таких порушень несумісна з|із| нормальним розвитком. Вперше|уперше| припущення|гадка| про існування такого циклу для окислення пірувата| в тваринних тканинах було висловлено в 1937 році Гансом Кребсом. Ця ідея народилася у|в,біля| нього, коли він досліджував вплив аніонів різних органічних кислот на швидкість поглинання кисню суспензіями подрібнених грудних м'язів голуба, в яких відбувалося|походило| окислення пірувата|. Грудні м'язи відрізняються надзвичайно високою інтенсивністю дихання, що робить|чинить| їх особливо зручним об'єктом для вивчення окислювальної активності. Кребс також підтвердив, що виявлені раніше в тваринних тканинах інші органічні кислоти (Янтарна|бурштинова|, яблучна, фумаровая| і щавельовоуксусная|) стимулюють окислення пірувата|. Крім того, він знайшов, що окислення пірувата| м'язовою тканиною стимулюється шестивуглецевими трікарбоновимі| кислотами - лимонної, цис-аконітової| і ізолімонной|, а також п'ятивуглецевою -кетоглутарової| кислотою. Випробувані|перевірені| були і деякі інші органічні кислоти, що зустрічаються в природі, але|та| жодна з них не виявила подібної активності. Звертав на себе увагу сам характер|вдача| стимулюючої дії активних кислот: навіть малої кількості будь-яким з них було досить|достатньо| для того, щоб викликати|спричинити| окислення у багато разів більшої кількості пірувата|. Прості експерименти, а також логічні міркування дозволили Кребсу висловити припущення|гадку|, що цикл, який він назвав|накликав| циклом лимонної кислоти, є|з'являється,являється| головним шляхом|колією,дорогою| окислення вуглеводів в м'язі. Після|потім|, цикл лимонної кислоти був виявлений практично у всіх тканинах вищих тварин і рослин і у|в,біля| багатьох мікроорганізмів аеробів. За це важливе|поважне| відкриття|відчинення| Кребс був удостоєний в 1953 році Нобелівської премії. Юджін Кеннеді і Альберт Ленінджер показали пізніше, що всі реакції циклу лимонної кислоти протікають в мітохондріях тваринних кліток|клітин|. У ізольованих мітохондріях печінки щури|пацюки| були виявлені не тільки|не лише| всі ферменти і коферменти| циклу лимонної кислоти; тут же, як з'ясувалося, локалізовані всі ферменти і білки, які потрібні для останньої стадії дихання, тобто для перенесення|переносу| електронів і окислювального фосфорилування. Тому мітохондрії з|із| повним|цілковитим| правом називають «силовими станціями» клітки|клітини|. Катаболічна роль циклу лимонної кислоти Цикл починається з взаємодії молекули ацетіл-СоА| з|із| щавельовоуксусной| кислотою (оксалоацетатом|), в результаті|унаслідок,внаслідок| якого утворюється шестивуглецева трікарбоновая| кислота, звана лимонною. Далі слідує|прямує| серія реакцій, в ході яких відбувається|походить| вивільнення двох молекул С02 і регенерація оксалоацетата|. Оскільки кількість оксалоацетата|, необхідне для перетворення великого числа ацетилових одиниць в С02, вельми|дуже| невелика, можна вважати|лічити|, що оксалоацетат| виконує каталітичну роль. Цикл лимонної кислоти є|з'являється,являється| механізмом, що забезпечує уловлювання більшої частини|частки| вільної енергії, що звільняється|визволяється| в процесі окислення вуглеводів, ліпідів і білків. В процесі окислення ацетіл-СоА| завдяки активності ряду|лави,низки| специфічних дегидрогеназ| відбувається|походить| утворення відновних еквівалентів у формі водню або електронів. Останні поступають в дихальний ланцюг|цеп|; при функціонуванні цього ланцюга|цепу| відбувається|походить| окислювальне фосфорилування, тобто|цебто| синтезується АТФ|. Ферменти циклу лимонної кислоти локалізовані в мітохондріальному матриксі, де вони знаходяться|перебувають| або у вільному стані, або на внутрішній поверхні внутрішньої мітохондріальної мембрани; у останньому випадку полегшується перенесення|перенос| відновних еквівалентів на ферменти дихального ланцюга|цепу|, локалізовані у внутрішній мітохондріальній мембрані. Реакції ЦТК| Початкова реакція - конденсація ацетіл-СоА| і оксалоацетата|, каталізує конденсуючим ферментом, цитратсинтетазой|, при цьому відбувається|походить| утворення зв'язку вуглець-вуглець між метальним| вуглецем ацетіл-СоА| і карбонільним вуглецем оксалоацетата|. За реакцією конденсації, що приводить|призводить,наводить| до утворення цитріл-СоА|, слідує|прямує| гідроліз тіоефірной| зв'язку, що супроводжується|супроводиться| втратою великої кількості вільної енергії у формі теплоти; це визначає протікання реакції зліва|ліворуч| на право до її завершення: Ацетіл-СоА + Оксалоацетат + Н2О = Цитрат + COA-SH Перетворення цитрата| в ізоцитрат| каталізує аконітазой|, що містить|утримує| залізо в двовалентному стані. Ця реакція здійснюється в дві стадії: спочатку відбувається|походить| дегідратація з|із| утворенням цис-аконітата| (частина|частка| його залишається в комплексі з|із| ферментом), а потім - гидратация| і утворення ізоцитрата|: Цитрат - цис| -Аконітат| = Ізоцитрат – Н2О Реакція інгибіруєтся| фторацетатом|, який спочатку перетворюється у фторацетіл-СоА|; останній конденсується з|із| оксалоацетатом|, утворюючи фторцитрат|. Безпосереднім інгібітором аконітази| є|з'являється,являється| фторцитрат|, при інгибірованії| накопичується цитрат|. Експерименти з використанням проміжних з'єднань|сполучень,сполук| показують, що аконітаза| взаємодіє з|із| цитратом| асиметричний: вона завжди діє на ту частину|частку| молекули цитрата|, яка утворилася з|із| оксалоацетата|. Можливо, що цис-аконітат| не є|з'являється,являється| обов'язковим інтермедіатом| між цитратом| і ізоцитратом| і утворюється на бічній|боковій| гілці основного шляху|колії,дороги|. Далі ізоцитратдегидрогеназа| каталізує дегидрогенірованіє| з|із| утворенням оксалосукцината|. Описані три різні форми ізоцитратдегидрогенази|. Одна з них, НАД-ЗАВІСИМАЯ|, знайдена тільки|лише| в мітохондріях. Дві інші форми є|з'являються,являються| НАДФ-залежними, причому одна з них також знаходиться|перебуває| в мітохондріях, а інша в цитозоле|. Окислення ізоцитрата|, пов'язане з роботою дихального ланцюга|цепу|, здійснюється майже виключно|винятково| НАД-ЗАВІСИМИМ| ферментом: Ізоцитрат + НАД+ - Оксалосукцинат (у комплексі з|із| ферментом)= α-кетоглутарат| + СО2+ НАДН2 Далі слідує|прямує| декарбоксилювання| з|із| утворенням альфакетоглутарата|, яке також каталізує ізоцитратдегидрогеназой|. Важливим|поважним| компонентом реакції декарбоксилірованія| є|з'являються,являються| іони Mg2+ (або Мn2+). Судячи за наявними даними, оксалосукцинат|, що утворюється на проміжній стадії реакції, залишається в комплексі з|із| ферментом. α-кетоглутарат, у свою чергу|своєю чергою|, піддається окислювальному декарбоксилірованію|, схожому з|із| окислювальним декарбоксилірованієм| пірувата|: у обох випадках субстратом є|з'являється,являється| альфакетокислота|. Реакція каталізує альфакетоглутаратдегидрогеназним| комплексом і вимагає участі того ж набору кофакторов| - тіаміндіфосфата|, ліпоата|, НАД+, ФАД| і СОА|; в результаті утворюється сукциніл-СоА| - тіоефір, що містить|утримує| високоенергетичний зв'язок. α-кетоглутарат + НАД+ + COA-SH = Сукциніл-СоА + СО2 + НАДН+Н+ Рівновага реакції настільки сильна зсунуто|здвинуто| у бік утворення сукциніл-СоА|, що її можна рахувати фізіологічно однонаправленої|однонапрямленої|. Як і при окисленні пірувата|, реакція інгибіруєтся| арсенатом|, що приводить|призводить,наводить| до накопичення субстрата (α-кетоглутарат |). Продовженням циклу є|з'являється,являється| перетворення сукциніл-СоА| в сукцинат|, що каталізує сукцинаттіокиназой| (сукциніл-СоА-синтетазой|): Сукциніл-СоА + ФН| + ГДФ =| Сукцинат + ГТФ| + COA-SH
Одним з субстратів реакцій є|з'являється,являється| ГДФ| (або ІДФ|), з|із| якого у присутності неорганічного фосфату утворюється ГТФ| (ІТФ|). Це - єдина стадія циклу лимонної кислоти, в ході якої генерується високоенергетичний фосфатний зв'язок на субстратном| рівні; при окислювальному декарбоксилюванні| α-кетоглутарату потенційна кількість вільної енергії достатньо|досить| для утворення НАДН| і високоенергетичного фосфатного зв'язку. У реакції, що каталізує фосфокиназой|, АТФ| може утворюватися як з|із| ГТФ|, так і з|із| ІТФ|. Наприклад: ГТФ+АДФ = ГДФ+АТФ. У альтернативній реакції, протікаючою в позапечінкових тканинах і такою, що каталізує сукциніл-СоА-ацетоацетат-СоА-трансферазой|, сукциніл-СоА| перетворюється в сукцинат| зв'язано з|із| перетворенням ацетоацетата| в ацетоацетіл-СоА|. Впечені є|наявний| діацилазная| активність, що забезпечує гідроліз частини|частки| сукциніл-СоА| з|із| утворенням сукцината| і СОА|. Далі сукцинат| дегидрогеніруєтся|, потім приєднується молекула води, і слідує|прямує| ще одна стадія дегидрогенірованія|, що приводить|призводить,наводить| до регенерації оксалоацетата|: Сукцинат + ФАД| «Фумарат + ФАДН2 Перше дегидрогенірованіє| каталізує сукцинатдегидрогеназой|, пов'язаної з внутрішньою поверхнею внутрішньої мітохондріальної мембрани. Це єдина дегидрогеназная| реакція ЦТК|, в ході якої здійснюється пряме перенесення|перенос| з субстрата на флавопротєїн| без участі НАД+. Фермент містить|утримує| ФАД| і железо-серний| білок. В результаті|унаслідок,внаслідок| дегидрогенірованія| утворюється фумарат|. Як показали експерименти з використанням ізотопів, фермент стереоспецифічен| до транс-атомів водню метіленових| груп сукцината|. Додавання|добавка| малоната| або оксалоацетата| інгібірує сукцинатдегидрогеназу|, що приводить|призводить,наводить| до накопичення сукцината|. Фумараза (фумаратгидротаза|) каталізує приєднання води до фумарату| з|із| утворенням малата|: Фумарат + Н2О «L-малат Фумараза специфічна до L-ізомеру малата|, вона каталізує приєднання компонентів молекули води по подвійному зв'язку фумарата| в конфігурацію транс. Малатдегидрогеназа каталізує перетворення малата| в оксалоацетат|, реакція йде за участю НАД+: L-малат + НАД+ «0ксалоацетат + НАДН2 Хоча рівновага цієї реакції сильна зсунуто|здвинуто| у напрямі малата|, реально вона протікає у напрямі оксалоацетата|, оскільки він разом з НАДН| постійно споживається в інших реакціях. Ферменти циклу лимонної кислоти, за винятком альфакетоглутарат-| і сукцинатдегидрогенази|, виявляються і поза|зовні| мітохондріями. Проте|однак| деякі з цих ферментів (наприклад, малатдегидрогеназа|) відрізняються від відповідних мітохондріальних ферментів. Енергетика циклу лимонної кислоти. В результаті|унаслідок,внаслідок| окислення, що каталізує дегидрогеназамі| ЦТК|, на кожну катаболізіруємую| за період одного циклу молекулу ацетіл-СоА| утворюються три молекули НАДН| і одна молекула ФАДН2. Ці відновні еквіваленти передаються в дихальний ланцюг|цеп|, локалізований в мітохондріальній мембрані. При проходженні по ланцюгу|цепу| відновні еквіваленти НАДН| генерують три високоенергетичні фосфатні зв'язки за допомогою утворення АТФ| з|із| АДФ| в процесі окислювального фосфорилування. За рахунок ФАДН2 генерується тільки|лише| два високоенергетичні фосфатні зв'язки, оскільки ФАДН2 переносить відновні еквіваленти на кофермент| Q і, отже, в обхід першої ділянки ланцюга|цепу| окислювального фосфорилування в дихальному ланцюзі|цепі|. Ще один високоенергетичний фосфат генерується на одній з ділянок циклу лимонної кислоти, тобто|цебто| на субстратном| рівні, при перетворенні сукциніл-СоА| в сукцинат|. Таким чином, за період кожного циклу утворюється 12 нових високоенергетичних фосфатних зв'язків.
Цитохроми| – ферменти редокс-ланцюга|цепу|. Подальше|дальше| перенесення|перенос| електронів від КоQН2 на О2 здійснює система цитохромів|. Дана система складається з ряду|лави,низки| гемсодержащих| білків (гемпротєїнов|), відкритих|відчинених| в 1886 році До. Мак-Мунном. Всі вони мають простетічеськую| геміновую| групу, близьку до гему| гемоглобіну. Цитохроми| відрізняються один від одного не тільки|не лише| простетічеськой| групою, але і білковими компонентами. Всі цитохроми|, особливо у відновленій формі, мають характерні|вдача| спектри поглинання, величини окислювально-відновних потенціалів також неоднакові. У механізмі гидроксилірованія|, що має широке розповсюдження|поширення|, шляхом введення|вступу| одного атома кисню функціональний атом заліза знаходиться|перебуває| в гемової| групі цитохрома| – цитохрома| Р450. Ці цитохроми| виявляються в мембранах печінкової ЕПС|, в мітохондріях кори надниркових, в нирковій щітковій облямівці і в плазматичних мембранах різних бактерій. Реакція, що каталізує, така ж, як у|в,біля| всіх інших монооксигеназ. МН| + О2 + 2е + 2Н= МОН| + Н2О Цитохроми| Р450 з|із| печінки належать до індукованих ферментів; це означає, що кількість присутнього ферменту може збільшуватися в 25 разів при введенні|вступі| одного з численних|багаточисельних| чужорідних сполук|сполучень,сполук|, наприклад фенобарбіталу або метілхолантрена|. Цитохроми| знешкоджують ксенобіотики, а також лімітують час, протягом якого можуть зберігати свою активність деякі наркотики. Лікування деяких форм гострої інтоксикації може бути полегшено введенням|вступом| індуктора, який в цьому випадку взагалі нешкідливий. Цитохроми| Р450 кори надниркових знаходяться|перебувають| в мітохондріальній мембрані, де два окремі ферменти каталізують відповідно розщеплювання бічних|бокових| ланцюгів|цепів| холестерину до прегненолона| і реакцій гидроксилірованія| різних стероїдов|. Цитохром| Р450 каталізує утворення гідроксильних груп при синтезі жовчних кислот, стероїдних гормонів, при катаболізмі ряду|лави,низки| речовин і обміні чужорідних з'єднань|сполучень,сполук|. Перша, виявлена в мікросомах електронпереносящая| система – це система відновлення цитохрома| b5 за рахунок NADH; цитохром| b5 відновлюється NADH-цитохром| b5-редуктазой, що містить|утримує| на молекулі один FAD, який здійснює|скоює,чинить| циклічні переходи між повністю відновленою і окисленою|окислюваною| формами. Цитохром| b5 міцно пов'язаний з ЕПС| своєю обширною|величезною| гидрофобной| областю. Хоча зовнішня поверхня області цитохрома|, де знаходиться|перебуває| гем|, гидрофільна|, вона лежить в глибокій гидрофобной| щілині, причому карбоксильні групи кислоти, пропіона, орієнтовані назовні. Відновлений цитохром| b5 поволі|повільно| самоокисляєтся| з|із| утворенням супероксидного аніона. Цей механізм може бути основним генератором супероксиду в клітках|клітинах| печінки.
|