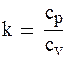Адиабатный процесс. Вследствие этого адиабатный процесс является теоретической абстракцией.
Процесс, в котором тепло к газу не подводится и от него не отводится, называют адиабатным. В этом процессе изменяются все основные параметры состояния. Адиабатный процесс на практике в чистом виде не встречается, так как между рабочим телом и окружающей средой всегда существует теплообмен. Вследствие этого адиабатный процесс является теоретической абстракцией. Аналитическое выражение первого закона термодинамики для адиабатного процесса, при котором q = 0, принимает следующий вид: (u2 – u1) + l = 0,откуда l = – (u2 – u1) = сv(T1 – T2). (1.75) Из этого следует, что в адиабатном процессе расширения газа работа совершается за счет уменьшения его внутренней энергии. В обратном процессе (адиабатного сжатия) затрачиваемая внешняя работа расходуется на увеличение его внутренней энергии. Уравнение адиабаты можно получать из первого закона термодинамики dq = du + dl, который с учетом dq = 0; du = cvdT и dl = pdv, можно записать cvdT + pdv = 0. (1.76) Учитывая, что
Откуда
и, подставив значение cv в уравнение первого закона термодинамики для адиабатного процесса, получим
Или
Дифференцируя уравнение pv = RT, получим pdv + vdp = R dT. (1.79) Подставив уравнение (1.78) в (1.79), получим pdv + vdp + (k – 1)pdv = 0, откуда vdp + kpdv = 0. (1.80) Разделив почленно уравнение (1.80) на pv и интегрируя полученное выражение при k = const, получим lnp + klnv = const или ln(pvk) = const, откуда можно получить уравнение адиабаты в следующем виде: pvk = const. (1.81) Кривая линия, выраженная уравнением (1.81), носит название обобщенной гиперболы (рисунок 1.14), площадь под которой (1-v1-v2-2-1) определяет работу процесса. Сравнивая уравнения изотермы (рv = const) и адиабаты (рvk = const), можно сказать, что при k > 1 адиабата будет проходить круче изотермы. По определению для адиабатного процесса dq = 0. Подставляя это в уравнение ds = dq/T, получим ds = 0, значит s = const, то есть в адиабатном процессе энтропия газа остается постоянной. Это значит, что в Ts координатах адиабатный процесс изобразится прямой линией, параллельной оси ординат (рисунок 1.15). Линия 1-2, имеющая направление в сторону увеличения температур, изображает процесс сжатия, а линия 1-3 – процесс расширения. Площадь, измеряющая количество подведенного те-пла, равна нулю, что соответствует смыслу адиабатного процесса. Так как в адиабатном процессе s = const, то этот процесс называют изоэнтропным процессом.
|