Состояния и процессы
Термодинамической системой тел (или системой) называют совокупность рассматриваемых тел, которые могут обмениваться энергией как друг с другом, так и с внешней средой, т.е. с телами, которые являются внешними по отношению к данной системе. Например, системой является жидкость и находящийся над ней в термодинамическом равновесии пар. Система может состоять из одного тела. Всякая система может находиться в различных состояниях, отличающихся температурой, давлением, плотностью, т.е. параметрами. Не всегда какой-либо параметр системы имеет определенное значение. Если, например, температура системы тел в различных ее точках неодинакова, то системе нельзя приписать определенное значение параметра Т. В этом случае состояние называется неравновесным. Если систему предоставить самой себе, то температура будет выравниваться и система придет в равновесное состояние. Если газ, находящийся в сосуде, начнем сжимать, то в первый момент давление в слое, прилегающем к поршню будет выше, чем в остальном объеме, т.е. давление окажется неодинаковым по объему и состояние газа будет неравновесным. Спустя некоторое время давление по объему выравнивается и система приходит в равновесное состояние. Равновесным состоянием изолированной системы называется такое состояние, при котором все параметры системы имеют определенные значения, остающиеся при неизменных внешних условиях постоянными сколь угодно долго. Процессом называют переход системы из одного состояния в другое. На графике любое равновесное состояние может быть изображено точкой. Неравновесное состояние не может быть изображено точкой, потому что хотя бы один из параметров не будет иметь определенного значения. Всякий процесс связан с нарушением равновесия системы. Следовательно, при протекании в системе процесса она проходит через последовательность неравновесных состояний. Быстрое и медленное вдвигание поршня при сжатии газа – это различная степень нарушения равновесия. В пределе, если сжатие газа происходит бесконечно медленно, газ в каждый момент времени будет характеризоваться определенным значением давления. Следовательно, в этом случае состояние газа в каждый момент времени является равновесным и бесконечно медленный процесс будет состоять из последовательности равновесных состояний. Процесс, состоящий из непрерывной последовательности равновесных состояний, называется равновесным. Равновесный процесс на графике изображается кривой (рис. 44).
Кривая 1-2 представляет собой равновесный процесс перехода системы из состояния 1 в состояние 2. Процессы, в которых при изменении состояния один из параметров остается постоянным, называются изопроцессами. Различают следующие изопроцессы: - изотермический (Т=const); - изохорический (V= const); - изобарический (P = const). Состояние газа описывается уравнением Менделеева-Клапейрона
где P- давление, V-объем, m- масса, M- молярная масса, R = 8,31∙103 Дж/(кмоль∙К) – молярная (универсальная) газовая постоянная. Физический смысл молярной газовой постоянной будет рассмотрен позднее.
|

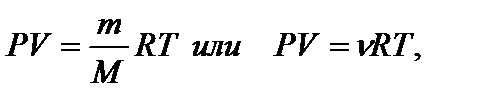
 - количество молей (или киломолей) газа, Т– абсолютная температура,
- количество молей (или киломолей) газа, Т– абсолютная температура,


