Работа Б-2. Определение коэффициента Пуассона
1. Цель работы Экспериментально определить коэффициент Пуассона для воздуха и сравнить полученное значение с теоретическим. 2. Приборы и принадлежности: 1. Закрытый баллон с краном. 2. Водяной манометр. 3. Ручной насос. 3. Краткая теория Системой тел или просто системой называется совокупность рассматриваемых тел или частиц. Некоторое количество газа состоящего из определенного числа молекул (частиц) представляет собой термодинамическую систему. Всякая система может находиться в различных состояниях, характеризующихся определенными параметрами. Основными параметрами, однозначно определяющими состояние газа, являются: объем
где R=8,31 Равновесным называется такое состояние системы, при котором: a) параметры во всех точках системы с течением времени не меняются; b) нет внешних воздействий, которые поддерживали бы эти параметры неизменными. Если хотя бы одно из этих условий не выполняется, то состояние системы является неравновесным. Графически равновесное состояние системы можно изобразить точкой, отложив по осям координат значения двух параметров (третий параметр однозначно определяется из уравнения состояния). Термодинамическим процессом называется изменение состояния рассматриваемой системы, например, данного количества газа Известны следующие равновесные процессы: 1. Изохорический процесс ( 2. Изобарический процесс ( 3. Изотермический процесс ( 4. Адиабатический процесс – процесс, протекающий без теплообмена с внешней средой, (энтропия Эти процессы можно графически изобразить на диаграммах непрерывными линиями, которые соответственно называют изохорой, изобарой, изотермой, адиабатой. Равновесные процессы являются обратимыми, так как их можно провести в обратном направлении через те же промежуточные состояния системы, что и при прямом ходе. Одним из фундаментальных законов термодинамики есть закон сохранения энергии с учетом механической и тепловой энергии. Такая общая формулировка закона сохранения энергии называется первым законом (началом) термодинамики:
Количество тепла Внутренняя энергия идеального газа определяется суммарной кинетической энергией поступательного и вращательного движений составляющих его молекул:
где Напомним, что числом степеней свободы Для характеристики тепловых свойств газа (тела) пользуются физической величиной, называемой теплоемкостью (удельной Удельная теплоемкость
Молярная теплоемкость
Между удельной
где Поскольку количество тепла Применяя первый закон термодинамики к изохорическому и изобарическому процессам и учитывая определение молярной теплоемкости, получим значения:
или Отношение теплоемкостей при постоянном давлении и при постоянном объеме:
зависит только от числа степеней свободы
4. Описание установки и методика измерений.
Если с помощью насоса накачать в баллон воздух, то его давление внутри баллона станет выше атмосферного, что отмечается разностью уровней воды в обоих коленах манометра. При нагнетании воздуха внешние силы совершают над газом работу, за счет которой увеличивается внутренняя энергия газа и, следовательно, его температура станет выше комнатной. По истечении трех - четырех минут в результате теплообмена температура воздуха в баллоне понизится до комнатной, давление в баллоне за счет этого станет немного меньше, и разность уровней манометра сократится до установившегося значения
 - атмосферное давление, - атмосферное давление,  - коэффициент пропорциональности. При быстром открывании на короткое время крана часть воздуха выходит, а оставшийся в баллоне воздух также быстро расширяется, и за это короткое время не успевает произойти теплообмен с окружающей средой, так что этот процесс можно считать адиабатическим расширением (кривая 1-2). Состояние 2 воздуха в баллоне характеризуется параметрами - коэффициент пропорциональности. При быстром открывании на короткое время крана часть воздуха выходит, а оставшийся в баллоне воздух также быстро расширяется, и за это короткое время не успевает произойти теплообмен с окружающей средой, так что этот процесс можно считать адиабатическим расширением (кривая 1-2). Состояние 2 воздуха в баллоне характеризуется параметрами  . При этом . При этом  < <  , так как при адиабатном расширении газ совершает работу за счет его внутренней энергии. При этом давление , так как при адиабатном расширении газ совершает работу за счет его внутренней энергии. При этом давление  (атмосферному). (атмосферному).
Для адиабатического перехода из состояния 1 в состояние 2 справедливо уравнение Пуассона
После закрытия крана через три – четыре минуты воздух в баллоне нагреется до комнатной температуры
Нагревание воздуха происходит при постоянном объеме
Возводим уравнение (4) в степень
Из последнего выражения находим показатель адиабаты:
Так как давления
Формула (5) является расчетной для определения коэффициента Пуассона 5. Порядок выполнения работы 1. Осторожно, чтобы не выплеснулась вода из манометра, накачать воздух в баллон до разности уровней воды в коленах манометра в 15 - 20 см. 2. Закрыть кран и выждать три - четыре минуты, за которые температура внутри баллона понизится до комнатной, то есть воздух в баллоне будет находиться в состоянии термодинамического равновесия, и уровни воды в манометре установятся. 3. По нижним краям менисков отсчитать разность уровней 4. Быстро полностью открыть и сразу же закрыть кран. За это короткое время часть воздуха выйдет из баллона до установления в баллоне атмосферного давления 5. Подождать три - четыре минуты, пока температура в баллоне не повысится до температуры окружающей среды. 6. Отсчитать разность уровней воды в манометре 7. По формуле (5) вычислить экспериментальное значение коэффициента 8. Пункты 1 - 7 проделать 10 раз и данные измерений и вычислений записать в таблицу. 9. Определить среднее значение 10. По среднему значению 11. Результат записать в виде
12. Сравнить полученное значение Таблица измерений и вычислений.
6. Контрольные вопросы 1. Записать и сформулировать первый закон термодинамики. 2. Что называется внутренней энергией идеального газа? 3. Применить первый закон термодинамики ко всем изопроцессам. 4. Что называется молярной теплоемкостью газа? Единица измерения. 5. Что называется удельной теплоемкостью вещества? Единица измерения. 6. Что называется изохорной и изобарной теплоемкостями газа? Их формулы через число степеней свободы. 7. Записать формулу Майера. 8. Определить физический смысл универсальной газовой постоянной. 9. Какой процесс называется адиабатическим? Уравнение Пуассона для этого процесса. 10. Что называется коэффициентом Пуассона? Записать его формулу. 11. Изобразить и сравнить в координатах 12. При каком расширении, адиабатическом или изотермическом, газ совершает большую работу и почему? 13. Как выгоднее сжимать газ, адиабатически или изотермически и почему? 14. Назовите все изопроцессы, запишите их условия, уравнения и графики в координатах
|

 , давление
, давление  , температура
, температура  . Эти величины связаны между собой уравнением состояния, которым для идеального газа является уравнение Менделеева - Клапейрона:
. Эти величины связаны между собой уравнением состояния, которым для идеального газа является уравнение Менделеева - Клапейрона: ,
, - универсальная газовая постоянная,
- универсальная газовая постоянная,  - число молей газа, которое в данном случае параметром не является, так как определенно задано.
- число молей газа, которое в данном случае параметром не является, так как определенно задано. ).
). ).
). ).
). , изоэнтропийный процесс).
, изоэнтропийный процесс). .
.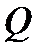 , сообщенное системе, идет на изменение (увеличение) ее внутренней энергии
, сообщенное системе, идет на изменение (увеличение) ее внутренней энергии  и на совершение системой работы
и на совершение системой работы 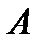 .
. ,
, - число степеней свободы молекул газа.
- число степеней свободы молекул газа. (три степени свободы поступательного движения), для двухатомной жесткой молекулы
(три степени свободы поступательного движения), для двухатомной жесткой молекулы  (три поступательные и две вращательные степени свободы), для трехатомной и более сложной жесткой молекулы
(три поступательные и две вращательные степени свободы), для трехатомной и более сложной жесткой молекулы  (три поступательные и три вращательные степени свободы).
(три поступательные и три вращательные степени свободы). и молярной
и молярной  ).
). ,
, - масса вещества, единица измерения в СИ:
- масса вещества, единица измерения в СИ:  .
. ,
,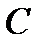 ]=
]=  .
. ,
,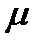 - молярная масса данного вещества (
- молярная масса данного вещества ( ).
). зависит от процесса, то для газов различают теплоемкости в зависимости от того, как идет нагревание: при постоянном объеме (
зависит от процесса, то для газов различают теплоемкости в зависимости от того, как идет нагревание: при постоянном объеме ( ) или при постоянном давлении (
) или при постоянном давлении (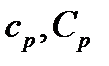 ).
). ,
, - формула Майера,
- формула Майера, .
.
 .
.
 . На диаграмме
. На диаграмме  (рис.2) это состояние обозначим точкой 1, параметры которого
(рис.2) это состояние обозначим точкой 1, параметры которого  . При этом давление
. При этом давление , (1)
, (1)



 . (2)
. (2) и его давление повысится до значения
и его давление повысится до значения  , что отмечается установившейся разностью уровней
, что отмечается установившейся разностью уровней  в коленах манометра. Так что
в коленах манометра. Так что (3)
(3) , поэтому процесс 2 - 3 является изохорическим. Конечное состояние 3 характеризуется параметрами
, поэтому процесс 2 - 3 является изохорическим. Конечное состояние 3 характеризуется параметрами  . Так как температура в состояниях 1 и 2 одинакова и равна комнатной
. Так как температура в состояниях 1 и 2 одинакова и равна комнатной  или
или  . (4)
. (4) и делим на уравнение (2):
и делим на уравнение (2): , или
, или 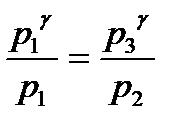 , или
, или  .
. .
. и
и  мало отличаются от давления
мало отличаются от давления  , то есть малые сжатия и разрежения воздуха, то разности логарифмов можно принять пропорциональными разности самих давлений. Тогда
, то есть малые сжатия и разрежения воздуха, то разности логарифмов можно принять пропорциональными разности самих давлений. Тогда  . В последнее выражение подставляем значения
. В последнее выражение подставляем значения  . (5)
. (5) .
. .
. .
. .
. .
.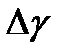 , а затем и ее среднее значение
, а затем и ее среднее значение  .
. .
.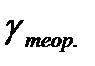 , вычисленным по формуле
, вычисленным по формуле  . Считать воздух двухатомным газом.
. Считать воздух двухатомным газом.
 графики изотермического и адиабатического процессов.
графики изотермического и адиабатического процессов. .
.


